Part I:リチウムイオン二次電池(LiB)の技術的背景
PartⅠではリチウムイオン二次電池(LiB)の技術的背景を記す。
まず、リチウムイオン二次電池について、その基本特性、原理、構成部材、市況概況、将来展望を述べる。引き続きリチウムイオン二次電池の構成部材について、「第2章 正極材」、「第3章 グラファイト」、「第4章 セパレータ」について詳細を記す。
<目 次>
第1章 リチウムイオン二次電池 ・・・・・・ 1
1.1 リチウムイオン電池の基本特性 ・・・・・・ 1
1.1.1 リチウムイオン電池誕生までの黎明期 ・・・・・・ 1
1.1.2 インターカレーション反応 ・・・・・・ 2
1.1.3 炭素負極の発展 ・・・・・・ 2
1.2 リチウムイオン電池の基本原理 ・・・・・・ 2
1.3 リチウムイオン電池の構成部材 ・・・・・・ 4
1.4 市場概況 ・・・・・・ 5
1.5 将来展望 ・・・・・・ 5
参考文献 ・・・・・・ 6
第2章 正極材 ・・・・・・ 7
2.1 正極材の変遷 ・・・・・・ 7
2.2 正極材を支える4元素 ・・・・・・ 8
2.2.1 リチウム ・・・・・・ 8
2.2.1.1 リチウムの世界生産・動向 ・・・・・・ 8
2.2.1.2 国内の需要動向 ・・・・・・ 9
2.2.1.3 炭酸リチウム ・・・・・・ 11
2.2.1.4 水酸化リチウム ・・・・・・ 11
2.2.1.5 金属リチウム ・・・・・・ 12
2.2.1.6 リサイクル ・・・・・・ 12
2.2.2 ニッケル ・・・・・・ 12
2.2.2.1 特性・用途 ・・・・・・ 12
2.2.2.2 世界の需給動向 ・・・・・・ 13
2.2.2.3 国内需給動向 ・・・・・・ 17
2.2.2.4 ニッケル生産企業動向 ・・・・・・ 18
2.2.2.5 リサイクル ・・・・・・ 20
2.2.3 コバルト ・・・・・・ 20
2.2.3.1 特性・用途 ・・・・・・ 20
2.2.3.2 鉱石タイプ ・・・・・・ 22
2.2.3.3 鉱床分布状況 ・・・・・・ 23
2.2.3.4 製錬方法 ・・・・・・ 25
2.2.3.5 国内の需給動向 ・・・・・・ 27
2.2.3.6 LiBからのコバルトリサイクルの状況 ・・・・・・ 30
2.2.4 マンガン ・・・・・・ 31
2.2.4.1 特性・用途 ・・・・・・ 31
2.2.4.2 世界の需給動向 ・・・・・・ 32
2.2.4.3 国内の需給動向 ・・・・・・ 33
2.2.4.4 リサイクル ・・・・・・ 35
参考文献 ・・・・・・ 35
第3章 グラファイト ・・・・・・ 36
3.1 天然黒鉛 ・・・・・・ 36
3.1.1 種 類 ・・・・・・ 36
3.1.2 産 地 ・・・・・・ 36
3.1.3 輸入状況 ・・・・・・ 36
3.1.4 製造(採鉱~生成黒鉛)方法 ・・・・・・ 37
3.1.5 採 掘 ・・・・・・ 37
3.1.6 精 製 ・・・・・・ 37
3.1.6.1 物理精製 ・・・・・・ 37
3.1.6.2 化学精製 ・・・・・・ 38
3.1.6.3 その他の生成法 ・・・・・・ 38
3.1.7 脱 水 ・・・・・・ 38
3.1.8 乾 燥 ・・・・・・ 38
3.1.9 粉砕・分級 ・・・・・・ 38
3.1.10 天然黒鉛の製造フロー ・・・・・・ 39
3.1.11 炭素材料の製造方法 ・・・・・・ 41
3.2 人造黒鉛 ・・・・・・ 43
3.2.1 製造 ・・・・・・ 43
3.2.1.1 混ねつ・成形 ・・・・・・ 43
3.2.1.2 一次焼成 ・・・・・・ 44
3.2.1.3 ピッチ含侵・二次焼成 ・・・・・・ 44
3.2.1.4 黒鉛化処理 ・・・・・・ 44
3.2.2 黒鉛者処理による結晶度化の評価 ・・・・・・ 44
3.2.3 黒鉛化処理を行った場合の炭素材料の形状変化 ・・・・・・ 46
3.2.4 原料及び処理条件が球形化に与える影響 ・・・・・・ 48
参考文献 ・・・・・・ 48
第4章 セパレータ ・・・・・・ 49
4.1 リチウムイオン二次電池(LIB)とそのセパレータ ・・・・・・ 49
4.2 車載用現行およびLIBセパレータの特徴と市場規模 ・・・・・・ 49
4.3 リチウムイオン二次電池(LIB)の世界市場規模 ・・・・・・ 50
4.4 LIBの構成と機能 ・・・・・・ 51
4.4.1 微多孔膜セパレータの開発状況 ・・・・・・ 52
4.4.2 セパレータ表面の無機物層塗布 ・・・・・・ 54
4.4.3 積層セパレータ ・・・・・・ 55
4.5 セパレータの製造フロー ・・・・・・ 55
4.5.1 乾式 ・・・・・・ 55
4.5.2 湿式 ・・・・・・ 56
4.6 二次電池製造における塗布・塗工 ・・・・・・ 57
4.6.1 ラミネート型セル製造における接着 ・・・・・・ 57
4.6.2 二次電池製造における機能付与・表面処理 ・・・・・・ 58
4.6.3 正極(アノード)の塗工(塗布) ・・・・・・ 59
4.6.3.1 正極(アノード)の塗工(溶剤系)の例 ・・・・・・ 59
4.6.3.2 正極スラリーの塗工(塗布)の例 ・・・・・・ 59
4.6.4 負極(カソード)の塗工(塗布) ・・・・・・ 59
4.6.4.1 負極(アノード)の塗工(溶剤系)の例 ・・・・・・ 59
4.6.4.2 負極スラリーの塗工(塗布)の例 ・・・・・・ 59
4.6.5 セパレータの組立 ・・・・・・ 60
4.7 電池製造における塗工品質の管理 ・・・・・・ 60
参考文献 ・・・・・・ 61
第1章 リチウムイオン二次電池
1.1 リチウムイオン電池の基本特性 [辰巳国昭、2011]
ハイブリッド自動車や電気自動車、プラグインハイブリッド車用電池として注目される、現在もっともエネルギー密度の高い蓄電池であるリチウムイオン電池の原理と、その特徴などについて概説する。リチウムイオン電池は、① 高いエネルギー密度・出力密度、②高い電池電圧、③高い充 放電エネルギー効率、④低い自己放電率、⑤残容量があっても充電が可能(メモリー効果がない)といったたいへん優れた特長を持ち、特に①~③については、図1.1.1に示すように、現存する二次電池の中でリチウムイオン電池は高い特性を示す。
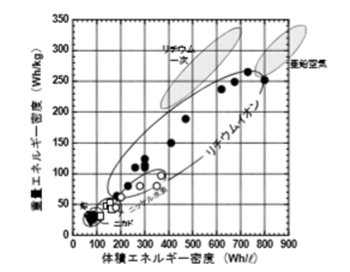
図1.1.1 各種民生用小型単電池のエネルギー密度比較
1.1.1 リチウムイオン電池誕生までの黎明期
金属リチウムは,元素中も低い電位を示し(-3.03 V vs. 標準水素極)、かつ金属元素中で単位電気量当たりの質量が小さいといった、負極として潜在的にたいへん優れた特徴を持つ。1970 年代に日本においてフッ化カーボン((CxF)n)を正極として、高電圧・高エネルギー密度のリチウム一次電池が世界で初めて民生用電池として実用化された。金属リチウム負極の放電反応(酸化)で溶解したリチウムイオン(Li+)は充電反応(還元)によって金属リチウムに戻るため,金属リチウム極は潜在的に蓄電池負極となり得る。ところが、リチウムイオンの還元反応により析出する金属リチウムが樹枝状に析出することは、蓄電池負極として、充放電効率、サイクル寿命、そして信頼性・ 安全性の点で致命的な問題であった。
1.1.2 インターカレーション反応
金属リチウムのデンドライト析出を抑制する研究と平行して、リチウムイオンを自らのホスト構造中に取り込む(このような反応をトポ化学反応(topochemical reaction)と呼ぶ)ホスト化合物を代替負極に用いる研究が1980年頃より台頭してきた。例えば1978 年にはマーフィー[Murphy, D.W., 1978]が、さまざまな酸化物へのリチウムイオンの電気化学的なトポ化学反応の起電力を報告した。その2年後の1980年にラツァリィら[Lazzari, M., 1980]は、マーフィーの報告において、酸化タングステン(WO2)が比較的低い電位(0.5 ~1.1 V vs. 金属 Li 極)を示すことに注目し、Li+を電気化学的なトポ化学反応で挿入した LixWO2を負極として、同じく電気化学的なトポ化学反応によって自らの層状構造にLi+を可逆的なインターカレーション反応を示す正極として1976年に見出されていたTiS2を正極とした、すなわち両極がトポ化学反応である電池を発案した。この電池は,両極が Li+ のトポ化学反応を利用する電池であり、後述するように現在のリチウムイオン電池の原型である。
1.1.3 炭素負極の発展
リチウム電池の研究でトポ化学反応型の電極材料の研究が 盛んになり始めた 1970 年代後半に、時をほぼ同じくして、炭素材料とリチウムの反応に関しても重要な発見がなされている。1975年に黒鉛がリチウムを自らの層間内に取り込みインターカレーション化合物を形成することが報告され[Guerard, D., 1975]、この黒鉛層間へのリチウムのトポ化学的な挿入/放出をリチウム二次電池の負極として用いる発明は、世界に先駆けて1981年に三洋電機の池田らによって行われた[池田宏之介、1981]。 また、1985~6 年に旭化成工業の吉野らは炭素負極[吉野彰、1986] を、1988年にはソニーの原田は粒状コークス[原田晋、1988] を負極に用いるリチウム二次電池の特許を出願している。特に、黒鉛以外の比較的結晶性の低い炭素材料もサイクル寿命の長い負極となることが報告されている[Kanno, R., 1989]、[Mohri, M., 1989]。
1.2 リチウムイオン電池の基本原理
金属リチウム極の蓄電池負極としての課題を解決するために、Li+をトポ化学反応で挿入・放出しうるホスト化合物を負極に用いるというアイデアのもと、炭素材料が金属リチウム 極に近い電位を示し,かつ充放電にともなう結晶の可逆性がたいへん高いことから、負極用ホスト化合物として炭素材料の可能性は高まった。しかし、炭素材料にリチウムが挿入された状態は充電状態であり、この状態で電池の製造を行うことは難度が高い。そこで、電池製造時には、放電状態、すなわち正極側にリチウムを含有する化合物の探索が行われ、これもトポ化学反 応系の化合物として1980 年にMizushimaらによってリチウム二次電池正極としての可能性が指摘 [Mizushima, K., 1980] されていたコバルト酸リチウム(LiCoO2)を正極に採用することで、高電圧(3.6 V)かつ従来の蓄電池よりも高いエネルギー密度を持つ蓄電池が1991年にソニーによって実用化された。この電池は、金属リチウムが電池系内に現れずに動作しうることから、リチウムイオン二次電池と名付けられて商品化されたが、ソニーはこの名称を一般化するために登録商標化することを控えたことから[電気化学会電気技術委員会、2010]、リチウムイオン電池(lithium-ion battery)の呼称は当該電池システムを現す一般的な技術用語ともなっている。
電池は図1.2.1 に示すように、酸化剤と還元剤を電子とイオンを仲立ちとして反応させ、そのときに放出されるギブズ(Gibbs)の自由エネルギーを直接電気エネルギーに変換するシステムである。定温過程のエネルギー変換であるので熱機関のようなカルノー(Carnot)の制約を受けず変換効率は高くなる。電池には使い切ってしまうと再充電できない若しくは再充電の効率が低いため廃棄される一次電池と、放電した後充電して再放電が可能な二次電池(蓄電池)がある。電池の放電では、正極で酸化剤 Ox1 が電子を受け取ることで還元されてRed2になり、負極で還元剤 Red1が電子を放出して酸化されて Ox2になる。
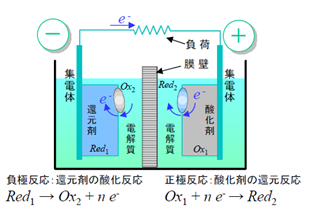
図1.2.1 電池の構成と放電時の電極反応
式(1)、(2)および(3)にリチウムイオン電池正極(LiCoO2)および負極(炭素材料または黒鉛),全電池反応を示す。式(1)~(3)は、左から右に充電反応を示している。
正 極:LiCoO2 ⇔ Li(1-x)CoO2 + xLi+ + xe- (1)
負 極:6xC + xLi+ + xe- ⇔ xC6Li (2)
全反応:LiCoO2 + 6xC ⇔ Li(1-x)CoO2 + xC6Li (3)
全電池反応式(式(3))に示すように、可逆電池反応は負極・正極の間をLi+が往復するのみで、電解液は電極反応に必要ではない(図1.2.2)。このような電池系は活物質となるイオン種が両極間を往復するイメージが、前後に揺れるロッキングチェアに似ていることから、ロッキングチェア型電池とも呼ばれる(その他にもスイング型やシャトルコック型などの呼称もある)。
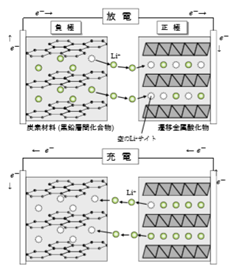
図1.2.2 リチウムイオン電池の原理模式図
1.3 リチウムイオン電池の構成部材
リチウムイオン二次電池の正極・負極物質、電解液の構成とそのセパレータに求められる特性と材質を表1.3.1に示す [藤原勝壽、2017][NEDO、2015]。
表1.3.1 リチウムイオン電池の極物質構成とセパレータの材質

1.4 市場概況
2018年のリチウムイオン電池(以下、LiB)主要4部材世界市場規模(メーカー出荷金額ベース)は、前年比134.2%の196億6,742万4,000ドルと推計される。LiB世界市場は2016年以降、車載用LiB市場を牽引役に成長が続いている。車載用LiB市場ではこれまで補助金政策で成長を続けた中国市場において、2019年からは環境規制が施行され、いよいよ外資系自動車メーカーの電動車ラインナップ分(M-HEV、HEV、PHEV、EV等)の需要が動き始めた。また、欧州では乗用車のCO2排出量について2021年の目標値を平均95g/kmとする規制を実施予定であり、2020年代前半までは欧州においても自動車メーカーの電動車(M-HEV、HEV、PHEV、EV等)の拡大が続くと見られ、車載用LiB向け主要4部材需要も引き続き拡大が予測される。
2018年のLiB主要4部材世界市場(メーカー出荷数量ベース)においても、引き続き中国メーカーは存在感を維持している。出荷数量における国別構成比では、正極材63.6%、負極材74.0%、電解液69.7%、セパレータ56.7%と、6割以上となっている正極、負極、電解液に続き、セパレータも2018年で6割に迫る勢いを見せている。
日本はセパレータが引き続き30%台を維持しており、他の部材は10数%~20数%台となっている。今後は欧州自動車メーカー、日系自動車メーカーの車両電動化における車載用セル向け需要増が日系部材メーカーの伸びを牽引するものと予測される。
1.5 将来展望
2019年からの中国の環境規制や、2021年に予定されている欧州における乗用車のCO2排出量の厳しい目標値設定のなか、世界市場においては、2020年代前半までは自動車メーカーの電動車ラインナップ(M-HEV、HEV、PHEV、EV等)生産が促進され、これを受けた車載用LiBの生産拡大が続くことで主要4部材需要の拡大は今後も続くと予測する。
ただし、今まで電動車市場を牽引してきた中国において補助金なき後、容量よりもコスト重視の観点からLFP正極材や乾式セパレータが見直される可能性、また世界的にはHEVが中長期的に成長する可能性も考えられ、この場合、これまでの高容量一辺倒の開発とは違う方向性での取り組みが求められることが予想される。さらに、これまでの容量価値に加え、今後の電池開発ではリユース等の観点から寿命価値という新たな開発の方向性が加わる可能性があり、LiB主要4部材に対する需要も変化する可能性があると考えられる [矢野経済研究所、2019]。
<参考文献>
○池田宏之助、1981、再充電可能なリチウム電池,日本国特許1769661 (出願 1981).
○辰巳国昭、2011、リチウムイオン電池の基本構造とその特長、Motor Ring, No.33, pp.1-3.
○電気化学会電池技術委員会、2010, 電池ハンドブック,pp. 370-4, オーム社.
https://www.jsae.or.jp/~dat1/mr/motor33/No33_03.pdf
○NEDO、2015、技術戦略研究センターレポート、車載用蓄電池分野の技術戦略策定に向けて、TSC Foresight, Vol. 5(2015年10月)
○原田 普, 1988, 二次電池,日本国特許 2621294 (出願 1988).
○藤原勝壽、2017、セパレータから見た二次電池・蓄電デバイス(前編)~ 2020年頃を目指したセパレータ業界の増産計画~、コンバーテック、Vo1 536,34-41(2017.11).
○矢野経済研究所、2019、リチウムイオン電池主要4部材世界市場に関する調査を実施、プレスリリース、No.2287.
https://www.yano.co.jp/press-release/show/press_id/2287 (矢野経済研究所)
○吉野 彰, 1986, 二次電池,日本国特許 2668678 (出願1986).
○Guerard, D., 1975, Intercalation of Lithium into Graphite and Other Carbons, Carbon, Vol. 13, pp. 337-345.
○Kanno, R., 1989, Carbon as negative electrodes in lithium secondary cells, J. Power Sources, 26, 535.
○Lazzari, M., 1980, A Cyclable Lithium Organic Electrolyte Cell Based on Two Intercalation Electrodes, J., 1980, Electrochem. Soc., Vol. 127, pp. 773-4.
○Mizushima, K., 1980, A New Cathode Material for Batteries of High Energy Density, Mat. Res. Bull., Vol. 15, pp. 783-9.
○Mohri, M., 1989, Rechargeable lithium battery based on pyrolytic carbon as a negative electrode, J. Power Sources, 26, 545.
○Murphy, D. W. 1978, Topochemical reactions of rutile related structures with lithium, Mat. Res. Bull., Vol. 13, pp. 1395-1402.
第2章 正極材
2.1 正極材の変遷
リチウムイオン電池の性能を決めるのが正極材料といわれているが、正極材の種類によって、コバルト系、マンガン系、ニッケル系、鉄系、三元系の5つのタイプに分けられる。そのうち、マンガン酸リチウム(LiMn2O4)を正極材につかったマンガン系リチウムイオン電池は、価格が安く(マンガンはコバルトの1/10)コバルトよりも安定性が高いため初期の電気自動車に多く採用された。マンガン系のリチウムイオン電池はスピネル構造という格子状の結晶構造を持ち、層状のコバルトやニッケルよりも頑丈で崩れにくいのが特徴で、そのため過充電安定性と熱安定性に優れている。半面、この構造によりリチウムイオンの数を出し入れする効率が落ちるため容量が上がらないという短所がある。マンガン系リチウムイオン電池はコバルト系と同じジョン・グッドイナフ博士によって1983年に提唱され、1996年にNECの系列会社により世界で初めて開発された。かつて電気自動車用リチウムバッテリーの主流だったマンガン系電池であるが、現在は三元系といわれる新しい電池に切り替わっており、今回の新型リーフもリチウムイオン電池の極材をマンガン系から三元系に変えたものである。三元系(三元系リチウムイオン電池)とは、コバルト、ニッケル、マンガンの三元素の化合物をつかった電池のことで、いわば3つの元素のいいとこ取りで、容量ではニッケル系(テスラ採用)に劣るが、寿命、熱安定性に優れており、テスラ以外の日欧米の電気自動車メーカーは現在次々とシフトしてきている状況である。
ハイブリッドカーの分野でもニッケル水素電池からスタートしたトヨタのプリウスが第二世代から三元系リチウムイオン電池に切り替わり、現在の車載電池の主流はマンガン系から三元系に完全に移行したようである。2016年の調査では大型二次電池世界市場の50%以上を電気自動車をはじめとするエコカー向けが占めているので、その中で主流となっている三元系は今後も伸びていくと思われる。
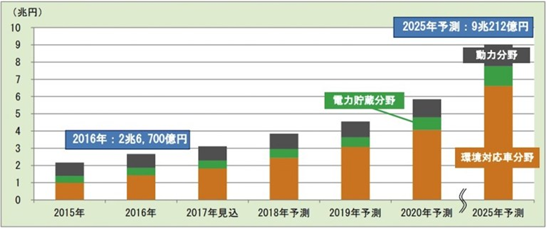
図2.1.1 世界市場における大型二次電池の用途 [影山遼将、2017] (出典:スマートジャパン)
大型二次電池の市場は用途別でみると、図2.1.1に示すように、2016年時点で電気自動車をはじめとするエコカー向けが50%以上を占めている。今後、電気自動車を中心にエコカー市場はさらに拡大する見込みで、これが市場の広がりを大きく後押しする。2025年には大型二次電池の用途分野の73%をエコカー向けが占めると予測している。
2.2 正極材を支える4元素
リチウムイオン二次電池で使用されている正極材は、主としてリチウム・コバルト系酸化物である。これらの正極材を構成する主要4元素(リチウム、ニッケル、コバルト、マンガン)について、生産・市場・需要状況について以下に述べる。
2.2.1 リチウム [米村和紘、2015]
リチウムは、主に二次電池や窯業利用されるアルカリ金属である。リチウム資源は、かん水およびリチウム鉱石(スポジュメンなど)の形で賦存している。かん水からは、かん水を1年半~2年程度かけ濃縮後中和し不純物を取り除いた後、ソーダ灰を添加することで炭酸リチウムが生産されている。一方、鉱石からは、硫酸や石灰と共に焙焼され、炭酸リチウムと水酸化リチウムが生産されている。リチウム中間製品の多くは、炭酸リチウムを出発原料として生産され、その中でも高品位な炭酸リチウムや水酸化リチウム、六フッ化リン酸リチウムはそれぞれリチウムイオン電池(以下、LiB)の正極材および電解液として利用される。炭酸リチウムは、このほかに窯業での利用も多く、耐熱ガラスや建材に用いられる。水酸化リチウムは、世界的にはグリース、国内では大容量が要求される自動車向けのLiBに多用される。
2.2.1.1リチウムの世界生産・需要
リチウムは日本への輸送が比較的容易な環太平洋の南米、豪州およびアジアに広く分布している(図2.2.1)。確認されている世界の埋蔵量は、全体で1300万純分tと見積もられ、このうちチリが世界全体の58%(750万純分t)を占め、中国(27%;350万純分t)、豪州(8%;100万純分t)、アルゼンチン(7%;85万純分t)と続く。ボリビアにも、ウユニ塩湖等にリチウムが賦存しているが未だ経済的な評価が行われていないため、埋蔵量として計上されていない。近年の動向としては、中国、豪州、アルゼンチン、米国、カナダで経済性評価が行われている探鉱・開発プロジェクトが多く、埋蔵量が増加する傾向にある。加えて未だに経済評価されていない探鉱プロジェクトも複数あり、今後も埋蔵量の拡大が見込まれ、世界的な埋蔵量としては当面十分と考えられる。
生産についてみると、2013年に世界全体で34,000純分tが生産されている。内訳をみると、豪州(38%;13,000純分t)とチリ(33%;11,200純分t)の割合が多く、中国(14%;4,700純分t)、アルゼンチン(7%;2,500純分t)がこれに続く。リチウムの賦存状況は地域によって異なっており、南米については、製品化に時間がかかるものの比較的生産コストの安い「かん水」の形で賦存するが、豪州・北米については、短期間で製品化できるものの生産コストの比較的高い「鉱石」として賦存する。アジア(中国)では、両方の形で賦存する。生産会社ごとに見ると、かん水からの生産は、Sociedad Quimica y Minera de Chile(“SQM”;チリ)、Rockwood(米)、FMC Lithium(米)3社の寡占状態で、全リチウム生産の5割近いシェアを3社で占める。
一方、鉱石からの生産は、Talison Lithium(豪)の生産が非常に多く、全リチウム生産の3割近くを同社で生産している。かん水からの生産と鉱石からの生産を技術的観点からみると、LiB向けに高純度のリチウムが求められるため、かん水からマグネシウムやホウ素などの不純物の除去が特に課題となっている場合がある。
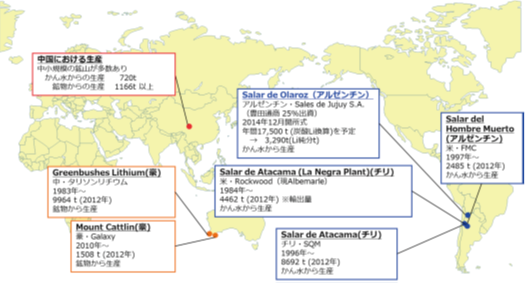
図2.2.1 リチウム鉱床の分布状況
世界のリチウム需要としては、概ね二次電池(正極材・電解質)向けと窯業向け(耐熱ガラス用、陶磁器の釉薬用)が主な用途で、それぞれ需要の3割ずつを占める。主な需要国としては、中国、ヨーロッパ、日本、韓国、北米が挙げられる。
2.2.1.2 国内の需給動向 [金属資源レポート_1、2017]
国内におけるリチウムの主要用途は、前述の用途とほぼ同様であるが、日本の特徴として、LIB 向け需要の占める割合が約7 割と高いことが挙げられる。炭酸リチウムは、携帯電話・PC 等の小型の民生用に使われるニッケル系以外のLIB の正極材材料(コバルト系、マンガン系、三元系)と電解質材料となる。水酸化リチウムは主にEV、HEV 等の自動車向けに使われる大型のニッケル系LIB の正極材材料に使われる。
品目別のリチウムの国内需要を表2.2.1、図2.2.2 に示す。2016 年の炭酸リチウムの合計需要量は前年比128.%と大幅に増加した。2013 年以降急増した水酸化リチウムは前年比103%と増加を続けている。この他、金属リチウムは同83%と減少し、塩化リチウム、ブチルリチウムは横ばいであったのに対し、臭化リチウムは同90%と減少した。
LIB 向け需要については、2010 年~2011 年まで順調に伸びていたが2012 年には炭酸リチウム、水酸化リチウムともに減少した。しかしその後は増加に転じ、2016 年については、炭酸リチウムは電解質向け、LIB 正極向けともに対前年大幅に増加した。水酸化リチウムのLIB 正極向けも2013 年以降、大幅に増加し、2016 年も増加を継続した。民生向けと比較して伸びの著しい自動車向けLIB 需要の増加により、水酸化リチウム需要は今後も増加するものと考えられる。
住友金属鉱山はパナソニックと共同開発のLIB 正極材料(ニッケル酸リチウム)の増産(マテリアルtで現在、年産10 千t→2018 年1 月1.9 千t→同年6月25千t)を発表している。なお、LIB 向け以外の窯業添加は前年比112%と増加し、グリース向けは横ばいであった。
表2.2.1 リチウムの国内需要 (マテリアルt)
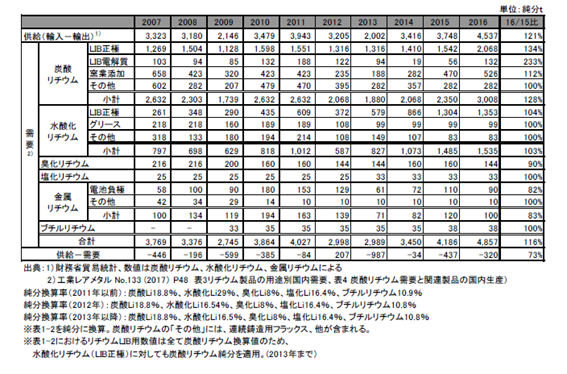
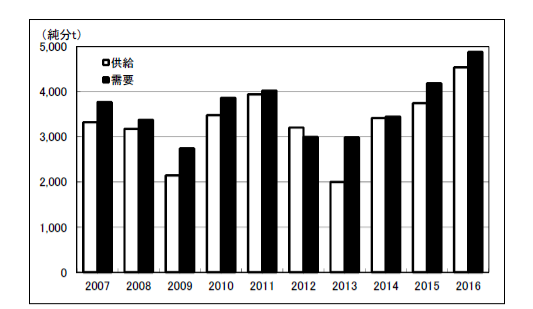
図2.2.2 リチウムの国内需要(マテリアルt)
2.2.1.3 炭酸リチウム
炭酸リチウムの主要用途は、ニッケル系以外のLIB 正極材、LIB 電解質、窯業添加(耐熱・HDD ガラス添加剤)、連続鋳造用フラックス、コンクリート補修材、医薬品等である。国内で使用される炭酸リチウムは全量が輸入品である。輸入品の純度は主にリチウム純分が99.0%程度の工業品グレードと、99.5%以上のバッテリーグレードの二種がある。通常、LIB 正極材にはバッテリーグレード品が使用され、耐熱・HDD ガラス添加剤、コンクリート補修材向けでは工業品グレードが利用されている。輸入した炭酸リチウムの一部は、国内で3N 以上の高純度炭酸リチウムに精製され、LIB 電解質、医薬品、SAWフィルター向けに使用されている。
炭酸リチウムはLIB生産量の減少とともに2012年、2013 年と需要量が減少していたが、2014年から増加に転じ、2016 年は正極材向けが前年比134%の11,000t(マテリアルt)と引き続き増加した。電解質向けは前年比233%の700tと倍増し、2010 年の水準に戻った。
窯業添加向けは前年比112%の2,800tと増加を継続したが、連鋳フラックス、SAW フィルター(LT(LiTaO3)、LN(LiNbO3)単結晶原料、医薬品、主に補修時に使われるコンクリート混和剤などのその他は前年並みであった。その他区分の主な内訳をみると、連鋳用フラックスは前年比85%の700tと減少したが、SAW フィルター向けは増加し、前年比110%の80tであった。
2.2.1.4 水酸化リチウム
水酸化リチウムの主要用途はニッケル系のLIB 正極材、グリース等である。水酸化リチウムは鉱石または炭酸リチウムから生産されるが、国内生産は行われておらず、国内で使用される水酸化リチウムは全量が輸入品である。国内メーカーは輸入品を微粉化、高純度化、無水化等の処理を行っている。
水酸化リチウムはLIB正極材向けの需要が増加し、前年比104%の8,200t(マテリアルt)であった。グリース向けは前年横ばいの600tであった。
2.2.1.5 金属リチウム
金属リチウムは、一次電池負極材の箔や、合金の還元剤として使用されるほか、合成ゴム重合触媒向けに使用されるブチルリチウムの原料となる。輸入品のほか、塩化リチウムから製造された国産品が使用されている。
金属リチウム需要の大半を一次電池負極材向けが占めているが、メーカー生産拠点の海外移転に伴い需要の減少が続いており、2016 年は前年比83%の100t(マテリアルt)と減少した。
2.2.1.6 リサイクル
リチウムのリサイクル率は、表2.2の定義により推計すると0%になる。ただし、使用済みLIBからリチウム等を回収する技術開発が国内外で行われており、リチウム価格が上がれば事業化が可能と思われる。
表2.2.2 リサイクル率の定義

※ 素材は炭酸リチウム、水酸化リチウム、金属リチウムの合計値
※ 国内発生量には、使用済み製品からのリサイクル量と製錬残渣等から回収された量を含む。
2.2.2 ニッケル [金属資源レポート_2、2018]
2.2.2.1 特性・用途
Niの用途の約70%はステンレス鋼で、原料として主にフェロニッケル(以下FeNi)が用いられる。Ni地金は特殊鋼(LNGタンク、自動車、船舶、機械向け構造用合金鋼)、ガスタービン用Ni基耐熱合金、メッキ、磁性材料(アルニコ磁石)等で利用される。硫酸Ni等のNi化合物が磁性材料、電池材料(Ni水素電池、リチウムイオン電池の正極材)、触媒材料として使用されている。「洋白・洋銀」(銅・Ni・亜鉛合金)は食器、貨幣などに古くから使用されてきた。めっきは19世紀に実用化された。その後、合金の開発が進みステンレス産業の発展に伴い需要が増大している。ニッケル金属は銀白色で展性・延性が高く加工性に優れることから、「洋白・洋銀」(ニッケル、銅、亜鉛の合金で銀白色の光沢を持つ)として装身具、洋食器、貨幣等に広く利用されてきた。 ニクロム(ニッケル、クロム、マンガン)線は発熱素子として電気ストーブ等身近な所で利用されている。また比較的耐食性があるので、メッキ材としてもよく使われており、1880年代には既に実用化されていた。
ニッケル資源はカナダ・豪州・ロシアを主な産地とする硫化鉱と、インドネシア・フィリピンを主な産地とする酸化鉱(ラテライト鉱)に分類される。資源量は酸化鉱の方が多い。製精錬プロセスは多種多様であり、硫化鉱は溶錬により作られたマットを、酸浸出し電解採取するか、焙焼して得られる酸化物を炭素で還元して、ニッケル地金が得られる。酸化鉱は、比較的品位の高いものについては、電気炉により還元されFeNiの一種であるNPIとなり、ステンレス鋼等の原料となる。また、品位の低いもの(リモナイト鉱)については、HPAL(HighPressure Acid Leach、高圧硫酸浸出)と呼ばれる高温高圧の硫酸でニッケル・コバルトを抽出し、硫化水素を加え硫化ニッケル・コバルト(ミックスサルファイドと呼ばれる)を作り、塩素浸出・電解採取等の処理を経てニッケル地金が得られる。
ニッケル地金は特殊鋼(LNGタンク用9%ニッケル鋼、構造用合金鋼の一部)、ガスタービン用ニッケル基耐熱合金、メッキ、非鉄合金(電子機器、海水淡水化プラント等)等で利用されている。
硫酸ニッケル、水酸化ニッケル、酸化ニッケル等のニッケル化合物は磁性材料(主にアルニコ磁石材料、スピーカー、モニター等)、IC材料、電池材料(ニッケル水素電池、ニッケルカドミウム電池、リチウムイオン電池の正極材)、触媒材料として使用されている。
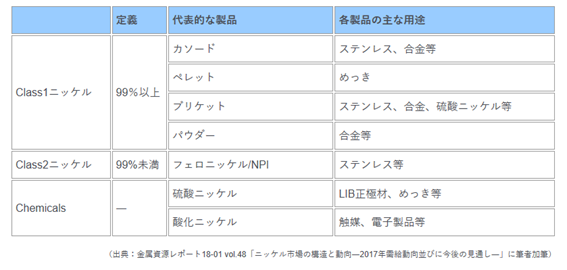
IoT時代を迎え脚光を浴びている積層セラミックコンデンサ(MLCC)には内部電極にニッケルが使用されている。なお、一次ニッケル(プライマリーニッケルとも呼ばれる。以下、一次ニッケル)とは製錬・精錬所の生産物で(製錬・精錬所以外の)消費者がそのまま使用できる形態の物を指す。一次ニッケル対象物は、ニッケル地金、FeNi、焼結酸化ニッケル(冶金用)、NPI、酸化ニッケル(化学用)、硫酸ニッケル、塩化ニッケル、炭酸ニッケル、酢酸ニッケル、水酸化ニッケル、その他のニッケル塩・化合物となる。
2.2.2.2 世界の需給動向
世界のニッケルの需給(鉱石生産、地金生産・消費)を表2.2.3、図2.2.3、図2.2.4に示す。2017年のニッケル鉱石の生産量は前年比105%の1,989千tと増加したものの2016年に続いて2,000千tを下回った。フィリピンの生産量減少の影響が大きい。世界の一次ニッケル生産量は前年比105%の2,078千tと初めて2,000千tを超え、一次消費量も前年比108%の2,192千tであった。
一次ニッケルの生産は、アジアでは中国が2016年は前年比96%と2013年までの増加基調から一転して3年連続の減少が続いたが、2017年は前年比109%と増加に転じた。日本は2015年までの3年連続の増加から2016年同様前年比98%と微減であった。また、アジアのその他の地域についてみると2016/2015比179%の184千tが更に2017年は前年比149%の275千tと増加し、アジア全体で全世界の半分以上を占めるに至った。そのうちインドネシアの生産量は前年比176%、204.8千tと前年に引き続き大きく増えた。2017/2015比は535%で中国の1/3に達した。
また、一次ニッケル消費はアフリカの微減を除き各国及び地域ともに100%を超え、全体では108%と堅調であった。ここでもアジアの存在は大きく、その構成比は75%を占めるに至っている。2016年までゼロだったインドネシアの一次ニッケル消費が51.6千tとの報告が注目される。
表2.2.3 世界のニッケル需給動向
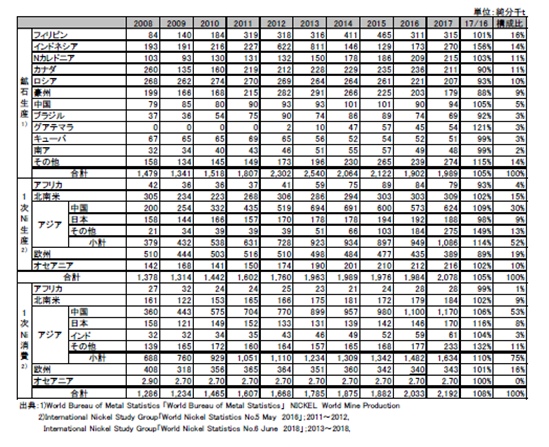
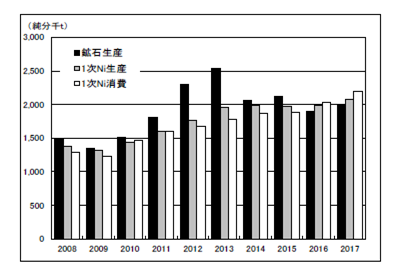
図2.2.3 世界のニッケル需給動向
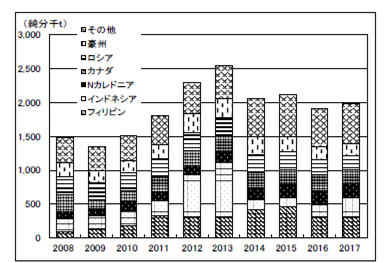
図2.2.4 世界のニッケル鉱石生産量
電気自動車(EV)時代の到来に伴いリチウムイオン電池(LIB)需要の増加が見込まれ、LIB正極材の原料として用いられるニッケルの需要増加が期待されている。ニッケル需要増加見通しを背景に2018年は1年を通じてロンドン金属取引所(LME)のニッケル在庫は減少傾向を辿ったが、ニッケル価格については他の非鉄金属価格と同様に米中貿易摩擦の動向による影響を受け、6月に2018年最高値を付けた後は下落傾向を辿り、10,595US$/tという安値で越年した。米中双方による度重なる追加関税措置の発動を受けて、金属製品の大消費国である両国における消費の低迷が懸念されたことが、ニッケルに限らず多くの非鉄金属価格の下落要因となった。
ニッケルの生産フロー・製品分類を概観する。ニッケル鉱山は硫化鉱と酸化鉱の2種類に大別され、それぞれ主要賦存国や資源量が異なる。図2.2.5のように、硫化鉱は主にブリケット、カソード、パウダー等のClass1ニッケルに、酸化鉱はフェロニッケルやニッケル銑鉄(NPI)といったClass2ニッケルの生産に用いられることが多い。Class1ニッケルはマット、MHP(ニッケル・コバルト混合水酸化物)、ミックスサルファイド(MS、ニッケル・コバルト混合硫化物)といった中間原料を通して生産される。EV普及に伴い注目度が高まるLIBの正極材料に用いられる硫酸ニッケルは、Class1ニッケルを硫酸で溶かして製造するフローが主流であるが、中間原料から直接製造するフローもある。
製精錬所における生産物であるプライマリーニッケルは、表2.2.4のようにClass1ニッケル、Class2ニッケル、Chemicalsと分類される。[柴原理沙、2019]
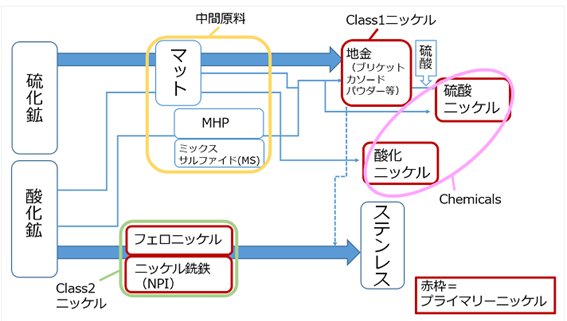
図2.2.5 ニッケル生産フロー
表2.2.4 プライマリーニッケル分類
2.2.2.3 国内の需給動向 [柴原理沙、2019]
LIB向けのニッケル需要については様々な予測がなされているが、リサーチ会社各社によると、2025年は160~400千t、2030年は410~680千t程度と、予測に幅がある。EVの普及状況や、LIB正極材に用いられる金属の構成次第で必要なニッケル量は変わってくるが、それらの要素は各国政府のEV補助金政策等による影響を受けるため、電池向けに必要なニッケル量を明確に見通すことは難しい。
LIB正極材の内、ニッケルが多く使用され今後生産増加が期待されるのが三元系(NMC)である。NMC正極材中のニッケルの割合が増えるほどEVの航続距離が長くなるため、高ニッケルNMCの需要増が期待されてきた。しかし、NMCについては、コバルト使用量を削減しニッケル使用量を増やした場合に安全性の問題や高コストに繋がることが指摘されている。また、EVにそれほど高い性能(高エネルギー密度)を求めなければ、高ニッケルNMCである必要性はないともいわれる。
EVやLIB正極材の動向に大きな影響を与えるのがEV販売台数の多い中国の動向であるが、中国のEV補助金政策が変化していることが今後の予測を立てにくい一因である。2019年3月に中国政府は新たなEV補助金政策を発表した6。同政策では、航続距離の短いEVに対する補助金は撤廃され、航続距離の長いEVに対する補助金は継続されるも、半減されることとなった。これまでは航続距離の長いEVに対する補助金の額が大きかったため、補助金の減額によって正極材の高ニッケル化の進展具合がやや停滞するのではないかとの見方もある。
このように、安全性・コスト・中国における補助金政策といった観点から、LIB正極材の高ニッケル化の進展に対して懐疑的な見方も出てきた点は、ニッケル需要を考える上で重要な点である。
なお、LIB正極材にはプライマリーニッケルの内、硫酸ニッケルが用いられる。硫酸ニッケルはブリケットやパウダー等のClass1ニッケルを硫酸で溶かして製造する方法や、中間原料から直接製造する方法等がある。INSGによる予測では、LIB正極材の原料となる硫酸ニッケルの生産量は2021年の時点で約100千tとされる(図2.2.6)。2025年時点でLIB向けに必要なニッケルは160~400千tとの予測があったが、2025年までに硫酸ニッケル生産がその水準まで増加するかどうかに注目が必要である。
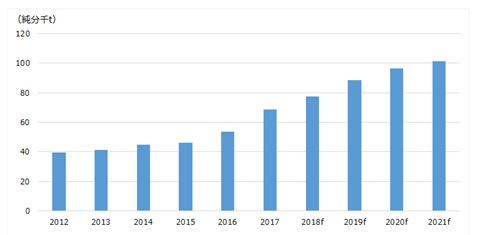
図2.2.6 硫酸ニッケル生産量推移予測
プライマリーニッケルの内、ほぼ全量がステンレス生産に用いられるClass2ニッケル(NPI/フェロニッケル)の生産量が増加しており、プライマリーニッケル生産量全体の増加を押し上げていることは前述した。Class2ニッケルから硫酸ニッケルを生産することは理論上は可能であるが、NPI→マット→硫酸ニッケルと転換するコストが高くつくことを考えると、現実的ではない。Class2ニッケルの生産量が直接的に硫酸ニッケルの供給面にプラスになることはないものの、Class2ニッケルの生産量が増加すればClass1ニッケル(特にブリケット)の内ステンレス生産向けに用いられる割合が減少し、その分硫酸ニッケル製造に振り向けることが可能となるため、硫酸ニッケルの供給にとってはプラス要因となる可能性がある。
2.2.2.4 ニッケル生産企業動向
2018年は、ニッケル生産企業がEV電池向けのニッケル需要増加を見込んでニッケル事業への投資を拡大したり、電池メーカーと協力したりするといった動きが顕著にみられた。以下、ニッケル生産大手のNorilsk Nickel社、Glencore、Valeおよび豪WA州Nickel West事業の注力に方針を転換したBHP、その他ニッケル生産で注目される企業の動向をまとめる。
① Norilsk Nickel社(露)
Norilsk社は2018年、219千tのニッケルを生産した。この内、ロシアにおける生産(Polar division、Kola MMC)は158千t、フィンランドにおける生産(Harjavalta精錬所)が61千tとなっている。同社は2019年、220~225千tの生産を予定する。
また、同社は2018年、ドイツの化学メーカーであるBASF社とニッケルの長期供給契約等に係る戦略的パートナーシップを締結した。BASF社はNorilsk社が保有するHarjavalta精錬所に隣接する場所にバッテリー材料工場を建設予定であり、EV向け電池市場の拡大が見込まれる欧州における電池材料の安定供給を意識した動きが見られる。
② Vale(ブラジル)
Valeの2018年ニッケル生産量は、前年比15.1%減少の244.6千tであった。減産の理由としては、2018年のカナダ・Thompsonにおける製精錬所の操業終了等が挙げられる。
また、2018年12月、Valeはニューカレドニアで操業するVNC鉱山の権益の一部を売却する計画を撤回し、2022年にかけて追加の投資を行うことを発表した。同鉱山は2014~2016年にかけて多額の損失を出しているが、今後のLIB向けニッケル需要拡大を見込んで追加投資を決断した。
③ BHP(豪州)
BHPは、豪WA州で操業するNickel West事業で採掘から選鉱・製錬に至るまでの一貫したプロセスによってClass1ニッケルを生産している。BHPはこれまで同事業の売却を検討してきたとされるが、2019年5月に事業継続を発表した。電池向けニッケル需要の増加が期待される中、高品質の硫化鉱ニッケルの供給不足が懸念されている状況に鑑み、成長が期待される分野として同事業に注力していく考えを表明した。
Nickel West事業ではKalgoorlie製錬所で生産した中間原料のマットをKwinana精錬所に供給しブリケットやパウダーを生産する。生産したブリケットやパウダーは、これまでは主にステンレス向けに供給されてきた。Kwinana精錬所では硫酸ニッケル製造にも着手しており、Stage1とStage2の2つのプロセスで硫酸ニッケルを製造予定で、Stage1では100千t/年、Stage2では200千t/年の生産を予定する。
④ Eramet社(フランス)
Eramet社は、ニューカレドニアでニッケルを生産する事業会社SLN社の権益を56%所有する。2019年4月、SLN社はニューカレドニア政府からニッケル鉱石輸出枠拡大の許可を取得したと発表した。これにより10年間にわたって4百万t/年のニッケル鉱石輸出が可能となり、2021年までにキャッシュコストを0.60US$/lb削減できるとしている。
また、Eramet社はインドネシアのWeda Bayプロジェクトの権益も保有する。同プロジェクトは中国の青山集団(Tsigshan)、インドネシア国有企業のPT Antamと共同で操業し、2020年Q1にNPI製錬所(生産能力30千t/年)の完成を予定する。
⑤ Independence Group社(豪州)
Independence Group社は、豪WA州Nova硫化鉱鉱山の権益を100%所有する。同鉱山における2018年のニッケル生産量は22,258tであった。2019年は27~30千tの生産を見込む。
2019年4月には同鉱山の硫化鉱精鉱から湿式製錬で直接硫酸ニッケルを製造する技術の商業化を進めるとの発表があった。これまで、硫酸ニッケルは中間原料あるいはブリケット等のClass1ニッケルを処理することでしか生産されていなかったが、同社は精鉱から直接高品質な硫酸ニッケル生産を目指しており、商業生産が実現すれば初の試みとなる。同社のプロセスによる硫酸ニッケルの商業生産に目処がつくまではニッケル精鉱の販売を継続するが、硫酸ニッケルはニッケルメタルよりプレミアムが高いため、同社では精鉱の販売より硫酸ニッケル販売の方が経済性が高いと見込んでいる。
2.2.2.5 リサイクル
ニッケルのリサイクル量を示す統計はないが、ステンレス鋼は経時劣化を起こしにくいため、使用済みステンレス鋼製品から再びステンレス鋼を生産しており、実際のリサイクル率は非常に高い。ステンレス鋼メーカーの中には、製造工程内で発生するダストやスケール類に含まれるニッケル合金成分の再資源化を目的に、回転炉床式還元炉等を導入してリサイクルを行っているところもある。
また、ニッケル水素電池(Ni-MH)においても以前はステンレス鋼向けに再利用されていたものが、現在ではバッテリーからバッテリーへのリサイクルが可能になっている。住友金属鉱山ではハイブリッド車(以下、HEV)から回収されたニッケル水素電池からニッケルを回収している。同じくJX金属でもHEV用LIB正極剤からニッケル、コバルト回収の実績がある。その他に量は少ないが、ラネーニッケル触媒(硬化油用ニッケル触媒)がニッケル金属としてリサイクルされている。その他、ニッケル・コバルト等のニッケル合金系の製造工程中のくずから一部ニッケルが回収されている。ただし、ニッケル、コバルトを分離せずに合金として再利用しているケースもある。
ステンレスでは最終製品からのニッケルの分離回収は行われていないが、ステンレス原料としてステンレススクラップの大半が活用されている。ステンレスメーカーによれば、国内のニッケル系ステンレスは生産量に対して2/3程度の割合でスクラップが使用されている。そのため、FeNiメーカーにとって、最大のライバルはスクラップとなる。SUS304系等の汎用鋼種は特に価格競争が激しく、ステンレスメーカーは安価な鉄、ニッケル源としてスクラップの使用比率を高めている。ただニッケル節約鋼種の200系は磁選ができないのでステンレスのリサイクル市場に悪影響がある。
2.2.3 コバルト[金属資源レポート_3、2018]
2.2.3.1 特性・用途 [赤堀道弘、2019]
表2.2.5にコバルト・ニッケル・銅の特性を示す。原子番号順に連続している3成分であるが、銅に対しコバルト・ニッケルは400℃程度融点が高いことが分かる。また密度はほぼ同等である。これらの特性を活かして、耐熱鋼や超硬合金の添加成分として無くてはならない成分となっている。
表2.2.5 コバルト・ニッケル・銅の特性
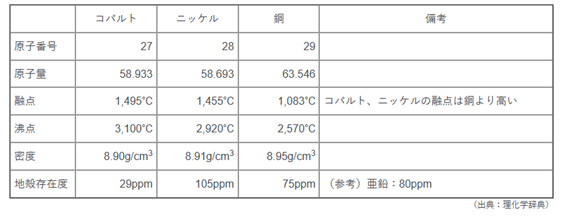
図2.2.7に2017年のコバルト用途を示す。バッテリー向けに半分以上が使用されている。続いて、高性能合金・工具材料・触媒向けに使用されている。
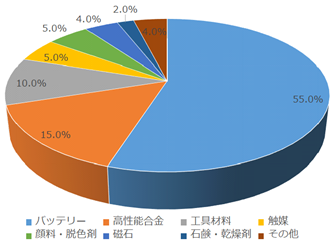
図2.2.7 2017年のコバルト用途
図2.2.8に2009年以降のコバルト消費量の推移を示す。2016年までの7年間に年平均で約9%の伸びを示したが、内訳を見るとバッテリー向け消費量がほぼ3倍へと大幅に増加している。今後は中国・欧州・北米で拡大している自動車の電動化に比例して、バッテリー向け消費がさらに増加することが予想される。
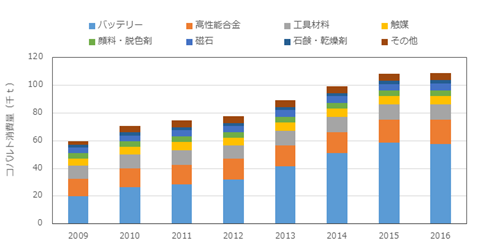
図2.2.8 2009年からのコバルト消費量の推移
(出典:Roskill データに基づきJOGMEC作成)
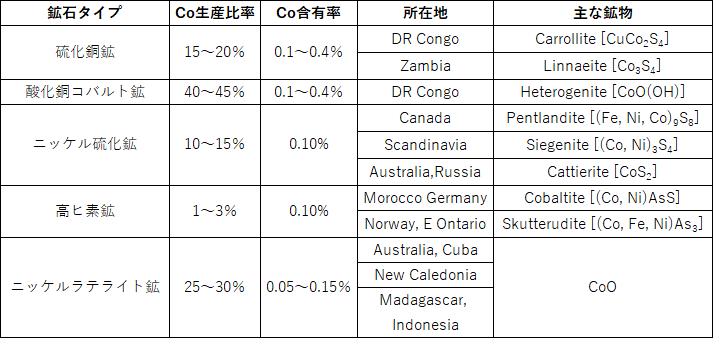
2.2.3.2 鉱石タイプ
表2.2.6に世界のコバルト鉱石タイプ・生産比率・含有量・所在地・主な鉱物等を示す。(カッパーベルト銅鉱石を薄茶色、ニッケル硫化鉱を薄青色、ニッケルラテライト鉱を薄緑色でそれぞれ示す。)アフリカのDRコンゴ・ザンビアのカッパーベルトより産出される銅鉱石中へのコバルト含有率が非常に高いことが分かる。また、このカッパーベルトより産出されるコバルト量は、世界の60%程度を占めており、銅製錬における副産物として回収されている。残りの40%はニッケル製錬からの副産物として回収されているが、足元はニッケルラテライト鉱からの湿式製錬技術の開発と進化により効率の良いコバルト回収が可能となり、ニッケル硫化鉱からのコバルト回収量よりも増加している。ただし、ニッケル硫化鉱中のコバルト品位は約0.6%と低いものの、浮遊選鉱により10%以上にまでコバルト分の濃縮が可能となるため、ニッケル製錬プロセスを用いたコバルト回収時にはコスト的に有利となっている。
表2.2.6 世界のコバルト鉱石タイプ・生産比率・含有量・所在地・主な鉱物等
2.2.3.3 鉱床分布状況
図2.2.9に世界のコバルト鉱床分布を示す。図中で、カッパーベルト銅鉱石を茶色・ニッケル硫化鉱を青色・ラテライト鉱を緑色でそれぞれ示す。世界のコバルト生産の大部分は、アフリカのDRコンゴ・ザンビアにまたがる層状銅鉱床、カナダ等に見られる硫化ニッケル鉱床、豪州等のラテライト質ニッケル鉱床の副産物として産出している。この図より、コバルトは偏在性の著しい金属資源となっていることが確認できる。豪州では硫化鉱も、またブラジルではラテライト鉱もそれぞれ産出するが、図では鉱量の多い鉱石を主として色分けしている。
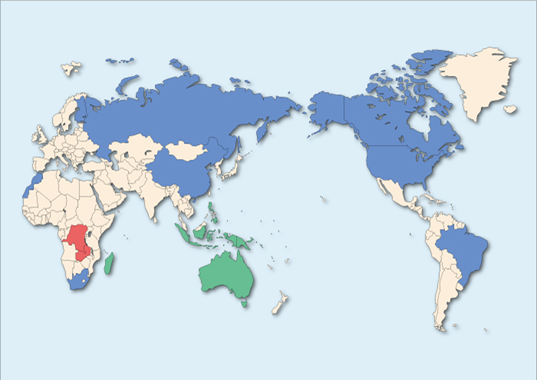
図2.2.9 世界のコバルト鉱床分布(JOGMEC作成)
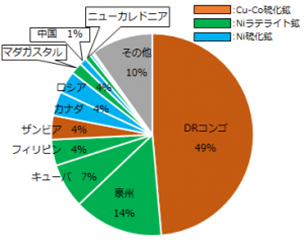
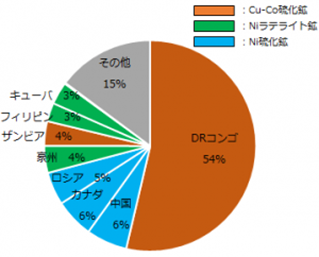
また図2.2.10に世界のコバルト埋蔵量を、図2.2.11に2016年のコバルト鉱石生産量をそれぞれ示す。
世界のコバルト埋蔵量の50%以上は、カッパーベルトに位置しているDRコンゴおよびザンビアに存在している銅鉱石が主となっており、生産量もDRコンゴ一国で世界全体の約54%を産出していることから、コバルトは偏在性の著しい金属資源となっている。
ニッケル鉱石では、硫化鉱からの生産国である中国・カナダ・ロシアがDRコンゴの次を占めているが、埋蔵量はラテライト鉱を埋蔵する豪州・キューバ・フィリピンの順となっている。
•
図2.2.10 世界のコバルト埋蔵量
•
図2.2.11 2016年のコバルト鉱石生産量
(出典:JOGMEC メタルマイニング・データブック2017)
2.2.3.4 製錬方法
先述のとおり、コバルトを含有する鉱物はカッパーベルトで産出する銅鉱石(酸化鉱および硫化鉱)と、ニッケル硫化鉱・ニッケルラテライト鉱に区別される。それぞれの鉱石に適した製錬方法によりコバルトを回収しているため、酸化銅鉱の湿式処理・硫化銅鉱の湿式処理・硫化銅鉱の乾式処理・ニッケル硫化鉱の乾式処理・ニッケル硫化鉱の湿式処理・ラテライト鉱の乾式処理・ラテライト鉱の湿式処理に大きく分けられるが、使用する薬剤の種類やプロセス方法の違いにより、更に細かく分けられる。そこで、概略を次に示す。
① 銅鉱石からの製錬方法
図2.2.12に、カッパーベルトで産出される銅鉱石からのコバルト製錬フローの概略を示す。同じカッパーベルトで産出される銅鉱石でも、DRコンゴでは主に酸化鉱が、ザンビアでは硫化鉱が産出される。そのため、DRコンゴでは酸化鉱をそのまま硫酸で浸出することで銅・コバルトを溶出させ、SxEw法により電気銅を回収し、その電解液からコバルトを水酸化物として回収している。
硫化鉱は、自前で酸化焙焼して酸化鉱に転換させることで硫酸浸出工程へ供給するか、硫化鉱からの処理を行っているザンビアへ輸送することで、ザンビア産出の硫化鉱と共に処理されている。ザンビアでは、硫化鉱を酸化焙焼により酸化鉱とした後に硫酸で浸出させ、DRコンゴと同様に銅・コバルトを溶出させ、SxEw法により電気銅を回収し、その電解液からコバルトを水酸化物として回収している。一方で、硫化鉱をそのまま自熔炉に供給して熔融させる乾式処理により粗銅を製造し、電解精製により電気銅を回収している。この時コバルトは自熔炉スラグ中に主に分配されるため、このスラグを電気炉内で還元することで銅-鉄-コバルト合金を製造して、これを中間品として回収している。
これら銅鉱石からのコバルト回収プロセスにおいて、浮遊選鉱時におけるコバルトの挙動が不明・浸出時におけるコバルト溶出率の低さ・スラグからのコバルト回収率の低さ等の問題点を含んでおり、未だそれらの解明が不十分である。
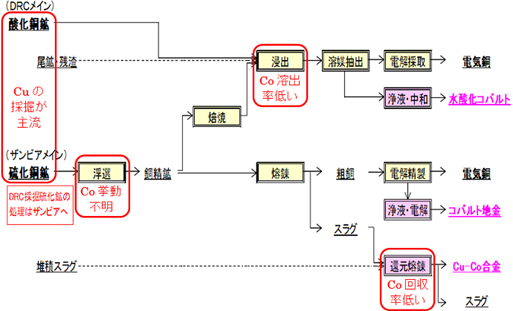
図2.2.12 カッパーベルトで産出される銅鉱石からのコバルト製錬フロー
② ニッケル鉱石からの製錬方法
図2.2.13に、ニッケル鉱石からのコバルト製錬フローの概略を示す。ニッケル鉱石は硫化鉱とラテライト鉱に分けられるが、その処理方法は非常に多い。詳しくは、JOGMEC金属資源レポートの中村威一「最新選鉱技術事情 鉱種別代表的プロセス編(2)―ニッケル―」および新井裕実子「ニッケル市場の構造と動向―2017年需給動向並びに今後の見通しについて―」を参考としていただきたい。大部分の製錬フローでは中間品としてニッケルマットおよび複雑硫化鉱を経由しており、乾式製錬における中間品にニッケルマットが製造され、湿式製錬においては複合硫化物が製造される。その中間品を浸出させ電解によりニッケルカソード、水素還元によりニッケル粉へ還元する製錬方法と、酸化焙焼により酸化ニッケルを製造する方法等に分かれる。また、これら中間品を経由しないフェロニッケル・ニッケル銑鉄の製錬方法に区別した。
これら以外の製錬方法として、ニッケルマットを直接アノードとして電解精製する場合や、アンモニア浸出後に水素還元によりニッケル粉を回収する方法もある。
複合硫化物の処理時にはニッケルマットも合せて処理する場合もあり、塩素ガスによる浸出でニッケル・コバルト・銅は塩酸溶液中に溶出させ、脱銅電解で銅粉として分離した浸出液を溶媒抽出によりニッケルとコバルトに分離して、それぞれ電解採取により電気ニッケル・電気コバルトとして回収している。
酸化鉱は、還元剤を加え電気炉等にて還元熔錬することで、フェロニッケルまたはニッケル銑鉄を製造している。しかし、この場合には原料中に含まれるコバルトは、生産物からは回収できない。また酸化鉱をキルンで乾燥と還元後、硫黄を加えて電気炉で熔錬しニッケルマットを製造する方法もある。
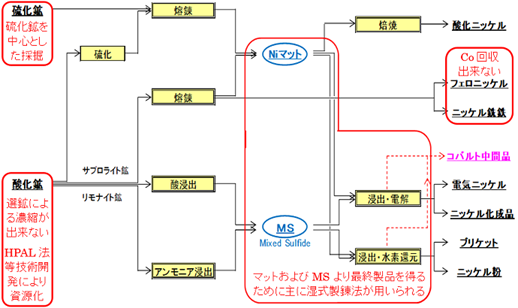
図2.2.13 ニッケル鉱石からのコバルト製錬フロー
2.2.3.5 国内の需給動向 [金属資源レポート_3、2018]
コバルトの国内需給動向を表2.2.7に示す。2017年のコバルト供給は前年比116%の14,874t、需要は前年とほぼ同じ5,534tであった。パウダーやブリケットの形状の地金のほか、地金から製造される酸化コバルト、硫酸コバルト、水酸化コバルト、塩化コバルト等各種の化合物が、幅広い用途で使用されている。
表2.2.7 コバルトの国内需給
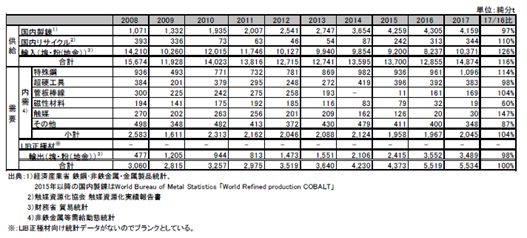
コバルトの国内最大の需要先はLIB正極材であり、酸化コバルトや硫酸コバルト等のコバルト化合物が主に利用されている。LIB正極材に使用されるコバルト需要を示す統計が存在しないため、表2.2.7の国内需給には同需要の数値は含まれていない。
参考として表2.2.8、図2.2.14、図2.2.15、図2.2.16に国内のLIB生産量及び容量を示す。車載用のLIBが個数、容量共に増加している。
LIB正極材にはコバルト酸リチウム(LiCoO2以下、LCO)、三元系(Li(Ni- Mn – Co)O2以下、NMC)、ニッケル系(Li(Ni-Co-Al)O2以下、NCA)、マンガン酸リチウム(LiMn2O4以下、LMO)、リン酸鉄リチウム(LiFePO4以下、LFP)などの化合物が用いられ、コバルトが使用される正極材はLCO、NMC、NCAの3種である。
また、車載用はLIBの使用量が大きい為、比較的高価なコバルトを回避する傾向もある中で、様々な観点から開発が進められている。開発の方向はハイニッケル化、コバルトフリー化の流れであり、ハイニッケル化の実用化も進んでいる。
表2.2.8 LiBの国内生産量および容量
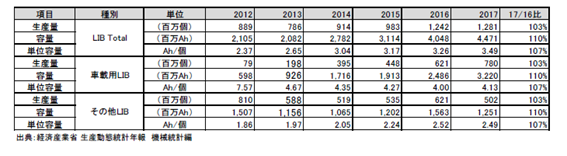
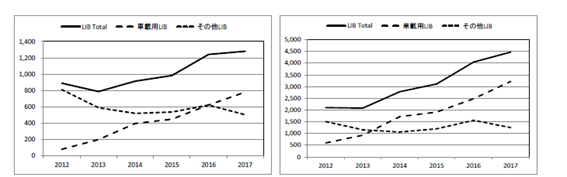
図2.2.14 LiBの国内生産量(百万個) 図2.2.15 LiBの国内生産容量(百万Ah)
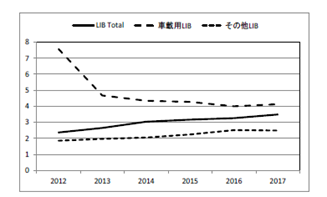
図2.2.16 国内生産LiBの1個当たり容量(Ah/個)
一方、車載用に比べてLIBの使用量が小さいスマートフォンなどにおいては、容量向上を目的とした高電圧化に対する小型化などのニーズが強い。LCOはある程度の高電圧化であれば材料との相性などを損なわずに電池特性を発揮できるため、LCOの需要増を支える要因になっている。
ただし、安全面を考えるとLCOにおける高電圧化には限界があるとの見方がある。このため、NMCでは、容量改善のため硫酸ニッケル比率を引き上るハイニッケル化の検討が進められている。現在は、NMCが車載用やノートパソコンやスマートフォン、デジタルカメラなどの民生品に採用され、NCAが車載用、ノートパソコンなどに採用されている。
LIB正極材に次ぐ大きな需要先は特殊鋼であり、LIB正極材を除いたコバルト需要の半分を占める。特殊鋼(スーパーアロイ(超合金とも称する))向け等では主には電気コバルト(コバルト地金)が使用されているが、一部で酸化コバルトも使用される。
コバルトを多く含む特殊鋼の主な用途は、刃先に用いられる超硬合金(WC/Co)、発電や航空機のガスタービン翼などに用いられる超耐熱合金(FeNiCo)、自動車などの無段変速機向け金属ベルト(CVTベルトとも称する)やゴルフクラブのヘッドに用いられるマルエージング鋼(マレージング鋼とも称する)などである。コバルトを使う特殊鋼の需要は、自動車分野の需要の影響が大きい。例えば、CVTベルトは省エネ目的で使用され、無段階でギアチェンジをすることにより燃費が向上する。2017年の特殊鋼向け需要量は、自動車生産台数増(前年比105%)とCVTベルト比率増の影響を受け、前年比114%、1,096tと大きく増え、初めて1,000tを超えた。一方、超硬工具向け需要量は、前年比98%と3年連続して緩やかな減少傾向を示している。
その他には磁性材料、板棒線等に電気コバルトが使用されているほか、触媒やめっき、陶磁器着色、サーミスタ等に各種のコバルト化合物が使用されている。ちなみに、コバルトを含む磁性材料は、フェライト磁石、希土類磁石である。
日本で電気コバルトを生産(国内製錬)しているのは住友金属鉱山社1社である。同社では、ニッケルマット及びミックスサルファイドから電気コバルトを精製している。
硫酸コバルトの国内生産量・輸出入量の統計数値は2015年まで無いが、2016年からその他の硫酸塩(硫酸コバルトを含む)についての統計データが入手可能となった。その他硫酸塩の輸入は財務省貿易統計で、2016年12.9千t、2017年15.6千t、2018年上期で8.7千tと増加傾向にある。(表4-2参照) 硫酸コバルトの主要用途はLIB正極材以外に、触媒、めっきがある。
酸化コバルトは、LIB正極材メーカーで自社消費分を生産している以外には、国内生産はない。輸入された酸化コバルトは、上述したLIB正極材、特殊鋼以外に、バリスター(半導体抵抗素子)、フェライトなどの電子材料の添加剤及びガラス、セラミックスの着色剤等として利用されている。
水酸化コバルトは国内に生産企業はなく、全量が輸入されており、金属石鹸や触媒原料等で主に使用されている。
塩化コバルトは、塗料、めっき、インキ乾燥剤用原料として利用される。酢酸コバルトは触媒向けに使用されている。
2.2.3.6 LiBからのコバルトリサイクルの状況 [赤堀道弘、2019]
今後自動車の電動化が進み自動車に搭載される電池の数量および容量の増大に伴い、リチウムイオン電池(LiB)の構成成分であるコバルト消費量が増加し、コバルトの供給が足りなくなることが懸念されている。そのため、廃LiBからのコバルトリサイクル技術の確立について取り進めることも急務となっている。現在のところ、コバルトのリサイクルを考えると、湿式法の方が乾式法よりも優れており、その際の回収率は≧80%になるとの報告が10th Lithium Supply & Market Conferenceにてあった。またその他の新技術としては、吸着剤によるLi、Co、Ni、Mnの選択分離法も存在するとの報告があった。
一方、LiB 廃電池よりコバルト回収を商業的に実施している企業としては、海外ではUmicore社(Hoboken工場)、Glencore(Sudbury工場)、カナダLi-Cycle Corp.社やAmerican Manganese Inc.社および中国企業で、また国内ではJX金属株式会社(敦賀リサイクル工場)、住友金属鉱山株式会社(新居浜工場)、DOWAエコシステム株式会社、日本重化学工業株式会社と松田産業株式会社等が既に取り組んでおり、新規技術・手法の開発や各社プロセスの流用により、LiB 構成成分であるCo、Ni、Mn、Li等のリサイクルを始めている。(表2.2.9、表2.2.10)
表2.2.9 各リサイクル製錬方法でのLiB 金属回収状況
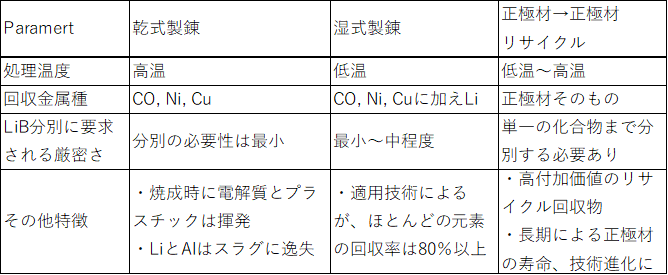
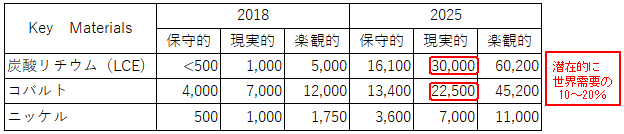
表2.2.10 LiBからのリサイクル可能な金属分推定供給量(t/年)
(出典:10th Lithium Supply & Market Conference Panel discussion時資料より)
2.2.4 マンガン [金属資源レポート_4、2018]
2.2.4.1 特性・用途
マンガンは銀白色の遷移金属で、空気中では酸化被膜ができ内部を保護する。マンガン自体は磁性を有しないが、合金及び化合物は様々な磁気特性を示すものがある。
マンガンは単体としては産出せず、酸化マンガン鉱(軟マンガン鉱(MnO2)、硬マンガン鉱(MnO2・nH2O)等)、炭酸マンガン鉱(菱マンガン鉱(MnCO2))、珪酸マンガン(パラ輝石(MnSiO3)、テフロ石(Mn2SiO4)等)として産出され、中でも酸化マンガン鉱の産出が最も多い。マンガンの鉱床には熱水鉱床、堆積性鉱床、風化残留鉱床、変成鉱床がある。深海底には鉄とマンガンの水酸化物の塊であるマンガン団塊等がある。
金属マンガンの生産方式には、湿式法(電解法)と乾式法(電離法、テルミット法)がある。工業的には電解法が大勢を占めている。電解法は鉱石を焙焼後、硫酸に溶解し、電気分解することで陰極板に金属マンガンを電析させる。電炉法は電気炉にて鉱石をコークス・珪石等により還元し、金属マンガンを生産する。テルミット法は酸化マンガンをアルミニウム粉末で還元し、金属マンガンを生産する方法である。
マンガンはそのほとんどが製鋼用に使用されている。脱酸・脱硫剤、強度及び特性向上を目的として鉄鋼添加剤としてフェロマンガン(以下、FeMn)及びシリコマンガン(以下、SiMn)が使用される。また、マンガン鉱石はFeMnの原料となる他、脱酸・脱硫剤、鉄鋼添加剤として転炉に投入される。マンガン需要は粗鋼生産の動向に大きく左右される。
金属マンガンは製鋼原料として使用される他、アルミニウムに合金元素として添加することで、アルミニウムの硬度及び強度が向上し、アルミ缶や屋根材、サイディング、パネル等の建築材、カラーアルミや電球口金に使われている。マンガンを含む普通鋼、特殊鋼、アルミ合金等は社会生活の中で幅広く使用されている。
原料の二酸化マンガン鉱石を粉砕し、一酸化マンガンへの還元、硫酸への溶解、精製を経て得られる高純度硫酸マンガン液を電気分解し製造される電解二酸化マンガンはアルカリ乾電池やLIBの正極材の原料に使用される他、フェライト磁石用材料として磁気諸特性の改善のために添加されている。また四三酸化マンガンはLIB正極材の原料に使用されている。さらに過マンガン酸カリウムは酸化剤として、酸化還元滴定用の分液試薬や有機合成、殺菌、漂白、火薬の原料、医薬品などの用途に広く用いられている。例えば飲料水中の有機物や臭気の除去やマンガンや鉄の除去にも利用される。
2.2.4.2 世界の需給動向
世界のマンガン鉱石の生産量を表2.2.11、図2.2.17に示す。2017年の生産量は前年比102%の61,163千tであった。生産量上位4か国では、中国が前年並み、南アとガボンは、前年比が、それぞれ105%、122%と増加した。その他の国ではガーナとインドの生産量が増加した。これらの生産量の増加は2017年のマンガン市況の回復によるものと推定される。
2015年~2016年のマンガン鉱石の市況は悪く、価格が低迷したが、中国の地条鋼への規制により、中国の粗鋼生産量が増加したことで、FeMnの需要が増えて、2017年に価格が上昇し、鉱石生産量も前年比で微増となった。なお、世界の需給動向について需要に関する公開データは無い。
表2.2.11 世界のマンガン鉱石生産量
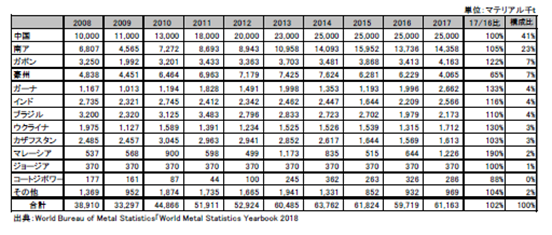
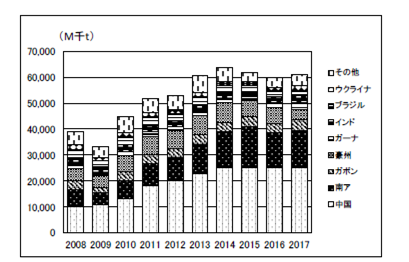
図2.2.17 世界のマンガン鉱石生産量
2.2.4.2 国内の需給動向
① フェロマンガン(FeMn)
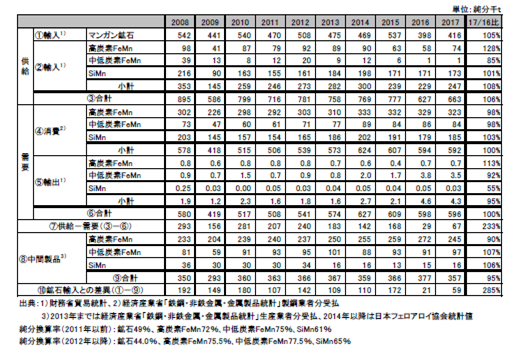
マンガンの国内需給を表2.2.12に示す。2017年の供給は前年比106%の663千t、需要は前年並みの596千tであった。なお、2017年のマンガン系合金鉄の生産について、経済産業省動態統計において2014年より、個別の生産量が非公表になったため、フェロアロイ協会の統計値を使用した。
FeMnの主要需要先は製鋼用であり、その需要量は粗鋼生産量に影響される。日本鉄鋼連盟によると2017年の日本の粗鋼生産量は前年並みの104.6百万tであったが、高炭素FeMnの消費量は前年比98%の323千tと微減となり、中低炭素FeMnの消費量は前年比84%の84千tと大きく減少した。
2016年の金属マンガンの市況が悪く、価格が安かったため、中低炭素FeMnから金属マンガンへ配合の変更をする生産者があった。また、ハイテン鋼の製造に金属マンガンが使用された。
鉄鋼生産において、高炭素FeMnとマンガン鉱石はどちらも主に一次製錬時に用いられるが、高炭素FeMnを利用した方がスラグ等の排出が少なく、製造時間も短縮できるため生産効率が高い。一方で、鉱石の直接投入の場合、生産効率は低下するものの、安価に製造することができる。鉄鋼メーカーとしては、安価な鉱石の使用比率を高めたいが、粗鋼生産量が増加し稼働率が高い時はスクラップ利用率が高まり、熱余裕が無くなる。その場合、鉱石は利用しにくくなる。つまり粗鋼生産量が増加すると高炭素FeMnの使用比率が高まり、粗鋼生産量が減少すると鉱石使用量が増加する傾向がある。鉱石はある程度大ロット(万tレベル)で輸入する必要があり、製鋼業者による鉱石の輸入量と実際の使用量は必ずしもリンクしない。
表2.2.12 マンガンの国内需給
② 金属マンガン
金属マンガンの主要用途は製鋼用及びアルミ合金用である。金属マンガンは全量が輸入されている。アルミ合金向けの電解金属マンガン需要はアルミ合金スクラップへの代替が進み、減少傾向にある。
③ 電解二酸化マンガン、四三酸化マンガン等
電解二酸化マンガン(以下、EMD)の主要用途は乾電池及びLIB正極材である。四三酸化マンガンはフェライト(Mn-Zn系)やNTCサーミスタ、LIB正極材で使用されている。
2017年の乾電池向けの需要は横ばいで推移しているが、電気自動車向けのLIB向けのマンガンの需要は、正極材の今後の動向の影響を受ける。
2008年に経済産業省は豪州(アンチダンピング(以下、AD)税率:29.3%)、スペイン(同:14.0%)、中国(紅星大龍(同:34.3%)、南アフリカ(同:14.5%))から輸入されるEMDに対してAD関税の賦課を決定した。元々の関税期間は2013年8月末まであったが、延長調査を経て2019年3月4日まで課税期間は延長されている。なお、豪州は生産企業が撤退したため、課税期間延長の対象から除外された。中国のEMD生産上位メーカーは、広西桂柳化工有限責任公司、湘潭電化科技股份有限公司、貴州紅星発展股份有限公司、CITICダーメンである。また、南ア唯一の生産者であるDeltaは2014年6月に操業を停止した。四三酸化マンガンメーカーは、金瑞新材料科技股份有限公司が挙げられる。
2.2.4.4 リサイクル
普通鋼や特殊鋼については鉄スクラップとしてのリサイクルが行われている。ただし、マンガンのリサイクル率を表2.2.12の定義により推計すると0%になる。 廃LIB中のマンガンの回収はマンガンの価格が安いことから、実施されていない。廃乾電池からのマンガン回収も実施されていない。LIBで、自動車用に使用できないものは、定置型畜電池として再利用される。
表2.2.12 リサイクル率等の定置

※ 使用済み製品からのリサイクル量とは、製品から原料・素材に戻る量を示す。
※ 原料は鉱石、素材は金属Mn(くずを含む)、高炭素FeMn、中低炭素FeMn、SiMn、二酸化マン ガン、四三酸化マンガン(二酸化マンガン以外)、過マンガン酸カリウム、過マンガン酸カリウム以外の合計値。
※ 国内発生量には使用済製品からのリサイクル量及び精錬残渣等から回収された量を含む。
<参考文献>
○赤堀道弘、2019、金属資源レポート、19-05、Vol.49.
○影山遼将、2017、スマートジャパン、2017.7.31.
○金属資源レポート_1、2017、鉱物資源マテリアルフロー 2017 8.リチウム(Li).
○金属資源レポート_2、2018、鉱物資源マテリアルフロー 2018 10.ニッケル(Ni).
○金属資源レポート_3、2018、鉱物資源マテリアルフロー 2017 10.コバルト(Co).
○金属資源レポート_4、2018、鉱物資源マテリアルフロー 2018 16.マンガン(Mn).
○柴原理沙、2019、金属資源レポート、19-07、Vol.49.
○米村和紘、2015、リチウムのマテリアルフロー、安定供給上の課題、金属資源レポート、2015.9.
第3章 グラファイト
3.1 天然黒鉛
3.1.1 種 類
天然黒鉛は大別すると結晶の発達した鱗状黒鉛と微結晶の土状黒鉛(Amorphous Graphite)に分けられる。鱗状黒鉛は、その形態から外観が薄い鱗状の鱗片状黒鉛(Flake Graphite)と 外観が塊である塊状黒鉛(Vein Graphite)に分けることができる。土状黒鉛の外観は塊状または砂状である。分類の一例を図3.1.1に示す。[杉本久典、2007]
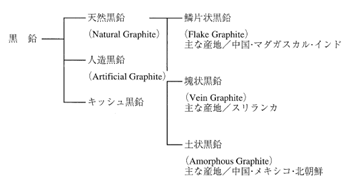
図3.1.1 黒鉛の種類
3.1.2 産 地
天然黒鉛の鉱床は世界に広く分布しており、各大陸において産出する。 しかしほかの鉱物 と同じように偏在もしている。現在およそ30力国で産出されているが、大きな鉱床があり、世界規模で市場へ供給できる国(地域)は限られてくる。大きな鉱床があっても小規模な採掘 しかしていない地域も多くある。鱗片状黒鉛の主産地は中国(山東省、黒龍江省、内蒙古自治区)、マダガスカル、インド、ウクライナ、ブラジル、ジンバブエであり、近年ではベトナム、カナダ、オーストラリアも供給源となっている。鉱石中における黒鉛含有率は5~25%程度である。塊状黒鉛の鉱床が確認されている産出国はスリランカだけであり、地中に黒鉛鉱脈を形成しているため含有率は70%以上である。土状黒鉛の供給国は中国、メキシコ、ドイツ、北朝鮮などである。塊状黒鉛と同様に黒鉛鉱脈を形成しており鉱石中における黒鉛含有率は60%以上である。
3.1.3 輸入状況 [杉本久典、2007]
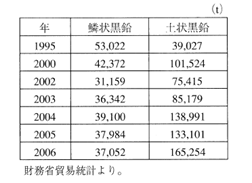
日本で使用される天然黒鉛(鱗状、土状)はすべて輸入品である。表3.1.1に天然黒鉛の輸入統計を示す。2006年の鱗状黒鉛の輸入量は37,000トンであり、そのうちの約97%を中国とスリランカが占めている。土状黒鉛は165,000トンであり、ほぼ全量が中国からの輸入である。
表3.1.1 天然黒鉛の輸入統計表
3.1.4 製法(採掘~精製黒鉛)方法
精製黒鉛は地中より採掘された原鉱石を粉砕し、浮遊選鉱法(黒鉛粒子を水に浮かせる)に より黒鉛だけを回収し、脱水、乾燥、粉砕・分級して製造する。
3.1.5 採 掘
鱗片状黒鉛は、どの産地においても大規模に露天掘りで採掘されている。塊状黒鉛の採掘 は、鉱脈に沿って地中を掘り進んでいく坑道掘りである。土状黒鉛の採掘も鉱脈を坑道掘 をしている。
3.1.6 精 製
3.1.6.1 物理精製
鉱石をクラッシャー(ジョークラッシャー、ハンマークラッシャー)で粉砕し、湿式にてチューブミルやボールミルで粉砕を進め、浮選機で黒鉛を回収する。チューブミル、ボールミルやその他の粉砕機と浮選機の工程をくり返し行うことによって純度を上げていく。
浮選機工程においては、水中に分散した鉱物粒子(懸濁液)に微量の気泡剤を添加し、槽内(水中)に 空気を送り込みながら撹拌することによって槽内(水中)に小さな気泡を立てて、この気泡に付着しにくい不純物粒子を沈降させ、懸濁液中にある黒鉛粒子を気泡に付着させて浮上分離して黒鉛粒子だけを回収する。不純物(泥水)は槽の底部から排出される。気泡剤は界面活性剤や油、油脂などであり、鉱物や廃水処理の状況を考えて使い分けられている。こうした物理的な方法によって98%ぐらいの純度を得ることができる。土状黒鉛の不純物は粒子が小さく、かつ黒鉛粒子中に分散している。このため鱗状黒鉛に比べて不純物の分離が困 難であり、純度95%ぐらいが限度である。
3.1.6.2 化学精製
物理精製によって純度90%以上に上げた後、アルカリ、酸を用いて不純物(シリカ、アルミナ、酸化鉄など)を溶かしだし純度を上げる[小野富三、1964、1967]。この方法によって純度99.9%の黒鉛を得ることもできる。
3.1.6.3 その他の精製法
純度95%以上の黒鉛を酸化しない状態で高温熱処理(~3,000℃)することにより高純度の黒 鉛が得られる。
3.1.7 脱 水
浮遊選鉱機によって回収された水中の黒鉛濃度は10%前後であり、遠心脱水機、フィルタープレス、オリバーフィルターなどによって固液分離が行われる。黒鉛の粒径にもよるが脱 水率は40~70%である。
3.1.8 乾 燥
キルン方式、熱風乾燥方式が主で行われている。中国、ベトナム、インドの一部においてはオンドル方式のところもある。
以上述べてきた採掘から乾燥の工程は鱗片状黒鉛の精製方法であって、塊状黒鉛については、鉱床から黒鉛の塊の状態で掘られているので産出国(現地)では精製はやられておらず、人(ベテラン)の目による選別が行われている。大きい塊は手斧で砕いて選別する。国内においては80~95%の純度の鉱石を輸入し、鱗片状黒鉛と同様の方法で精製を行っている。
土状黒鉛も塊状黒鉛同様に鉱床から採掘されているので、産出国(現地)において精製は行われない。国内においては、高純度の土状黒鉛粉末が求められているので鱗片状黒鉛と同様 の方法で精製を行っており、純度99.5%のものも得られている。
3.1.9 粉砕・分級
黒鉛は性状的に非常にやわらかい物質であり、多結晶的に粒子の集合からなっているため、粉砕方法(粉砕機、粉砕機構)によって生成粒子に特徴が現れることになるので要求に応じた粉砕方法(粉砕機)を選ぶことが重要である。一般的には、ハンマーミル、ジェットミル等々の衝撃粉砕機が用いられる。分級は粒径によって風力分級(セパレーター)と篩分級に分かれる。
明確な線引きはできないが、粒径が50μmぐらいを境にして粗い黒鉛は節分級、細かい黒鉛は風力分級としている。節分級は粒子に振動を与えながら網目の上を流し選別する方法であり、風力分級(セパレーター)は気流中に黒鉛粒子を分散させて、セパレーター(回 転帯)を通過させて選別する方式である。気流中の濃度、回転帯の回転数等々によって得られる粒径および粒度分布が決まってくる。分級された黒鉛粉末はタンクに貯蔵された後検査を受け梱包される。製品としては、形状が鱗片状以外に球状に粉砕された黒鉛や、非常に薄く粉砕(厚みが100nm以下)された黒鉛や、表面積を非常に大きく粉砕(BET 300 m2/g以 上)した黒鉛や、粒径が300nm以下に粉砕した黒鉛が製造されている。
天然黒鉛粉末の特性は、その粉砕方法によって大きく異なるので参考までに紹介する。表3.1.2および図3.4に鱗状黒鉛の粉砕方法の違いによる代表的な粉末の形状と代表特性の一例を示す。一般粉末に比べて球状黒鉛は見掛密度が大きく,配向性(アスペクト比)と比表面積が小さくなっている。薄片黒鉛は見掛密度と比表面積が小さく,配向性が大きくなっている。
表3.1.2 粉砕方法の違いによる特性値
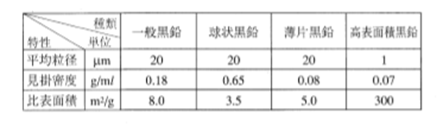
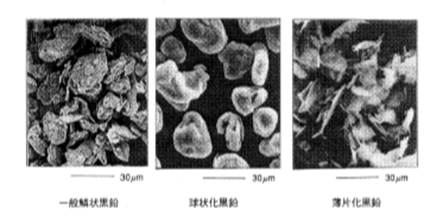
図3.1.2 黒鉛粉末の形状
3.1.10 天然の製造フロー
図3.1.3に、産出国において行われる天然黒鉛の製造フローを示す。採掘、粉砕、浮遊選鉱、物理精製の各工程を経て90%程度までの純度にして輸出する。
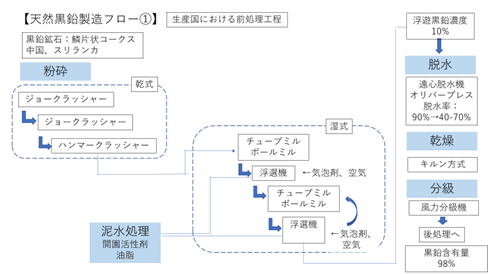
図3.1.3 天然黒鉛の製造フロー①
図3.1.4は、国内に輸入された後の天然黒鉛に関する製造フローである。化学処理による不純物低減化処理、球形化処理、炭素化処理、黒鉛化処理、高純度化処理等の流れとなる。
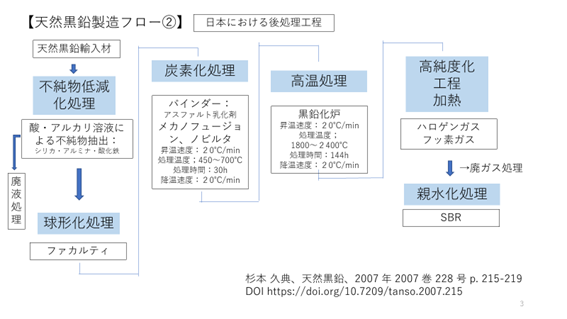
図3.1.4 天然黒鉛の製造フロー②
3.1.11 炭素材料の製造方法 [岡崎精二、2016]
炭素材料は、非酸化性雰囲気下で、有機物を加熱することで、熱分解を起こし、生成される。木炭などは、古来より、木々を不完全燃焼されることで得られ、現在でも基本的に同じ製法にて製造され、今なお使用されている。しかしながら、工業用途で大量かつ安価に炭素材料を得ようとするならば、地下資源である、石炭、天然ガス、石油、天然黒鉛などが出発原料とされる。例えば、石油重質油を高温で熱処理することで、液状成分(各種燃料)やガス成分が抽出され、最後の固状残渣が残る。
熱処理の方法としては、その主なものは、デレードコーキング法、フルードコーキング法、バッチ式コーキング法、連続コーキング法などである[真田雄三、1969]。この過程で得られた液状成分は、有機物からの炭素原料[大谷朝男、1988]に用いられることもあり、残渣である石油コークスは、さらに熱処理を重ねて、炭素原料として使用されていく。同じように石炭についても乾留を行うことで、液状成分や石炭コークスとして炭素の原料に使用される。
これらのコークス原料は、地下資源であり、何処で採掘されたかによって、特性が大きく異なってくる。「炭素材料の性質は、その生まれた過程によって決定される」と言われる所以である。
原料油は、不純物量が多いもの、特定の不純物を含むもの、比較的不純物の少ないものなど、産地により異なり、高電力操業用の黒鉛電極に用いるコークスは、易黒鉛化性、低抵抗の特性が求められ、不純物の少ない針状コークス(needle cokes)が用いられる[Tano, 2009]。他方、不純物の多いコークスは、モザイクコークス[Mochida, 1980]と言われ、等方的な結晶構造を持ち、特殊炭素材料として用いられることが多い。成型体にして黒鉛化する特殊炭素材料は、熱処理により結晶が膨張することで、成型体にクラックが入ることがある。よって、原料としても等方的な結晶構造の炭素を用い、その後の製法としても粉砕-混ねつ-再粉砕を行うことで、より等方的な性質を発現させ、成型にはCIP成型(Cold Isostatic Pressing 冷間等方圧加工法) を行うと言ったかなり長いプロセスで製造されている[Tojo, 2008]。
図3.1.5に、石油系コークスのニードルコークスおよびモザイクコークスの偏光顕微鏡の画像を示した。偏光顕微鏡では、結晶面の方向の異なるところが、違った色彩で表される。モザイクコークスは、その名の通り、モザイク状に、ニードルコークスは、流れ構造の結晶であることが確認できる。これらの違いは、石油を発掘する産地によって、炭素原料中の不純物の種類や量が異なることに起因する。石油の多くは、遠い昔の動植物が原料となっている。恐竜などの大型動物が原料になっている産地では、炭素材料の中に、血液中に存在していたバナジウムや鉄などが多く混入したりする。これらの不純物が、生成過程および熱処理過程で結晶成長を阻害し、ランダムな結晶構造を生む。このランダムな(モザイク)結晶構造の強いコークスがモザイクコークスである。

図3.1.5 偏光顕微鏡写真 (a)ニードルコークス、(b)モザイクコークス
熱処理前の炭素材料には、大きく分け、易黒鉛化炭素 Soft carbon と 難黒鉛化炭素 (Hardcarbon) に分けられる。 易黒鉛化炭素とは、その名の通り、高温で熱処理することで、黒鉛結晶になり易い炭素である 。他方、難黒鉛化炭素とは、高温で熱処理しても黒鉛になり難い炭素 である。これらの理由は、 図3.1.6に示すように、難黒鉛化炭素は、結晶構造が、ランダムに配列されており、結晶成長が阻害されるためである。前出の微視構造の写真を比較して明らかなように、モザイクコークスは不純物が少なく熱処理による結晶成長が起きやすいが、一方不純物が多いモザイクコークスについては、結晶成長が阻害されることにより良好な黒鉛を生成しにくいということになる。最終的には、熱処理により、図3.1.6の右端の図に示すような平面的な結晶が層状に積層された黒鉛の結晶が最終的に理想的な結晶構造となる。

図3.1.6 炭素材料のモデル化の例
3.2 人造黒鉛
3.2.1 製 造 [東日本株式会社、2020]
天然黒鉛に対して人工的に製造した黒鉛が人造黒鉛である。人造黒鉛は、単純に言えばコークスを黒鉛化したものであるが、実際にはかなり複雑なプロセスで製造される。まず、原料となるコークスには石炭コークスと石油コークスがある。石炭コークスは、現在でも製鉄では普通に使用されている。石炭との違いは見た目がガサガサしている点で、高純度の石炭は光沢があるが、コークスはガサガサした外観である。これは、石炭を1300℃以上で乾留(蒸し焼き)したものがコークスで、そのため、揮発成分やタール、硫黄分などが抜けて多孔質になっているためである。石油コークスはその名の通り石油精製過程で得られるもので、石油コークスと言っても固形である。人造黒鉛の製造には石炭コークスも石油コークスも使用される。図3.2.1に、人造黒鉛の製造フローの例を示す。
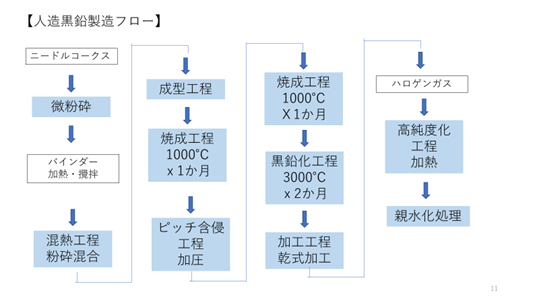
図3.2.1 人造黒鉛の製造フロー
3.2.1.1 混ねつ・成形
次に原料コークスをバインダーピッチと呼ばれるものと混合して加熱しながら練り合わせます。均一になるように混合する。その後、粉砕して粉状にしたのち成形する。代表的な成型は押し出し成形である。例えば、円形の穴から押し出すと円柱状の成形体ができる。この場合、成形体には異方性が生じ、例えば、電流の流れやすさが円柱の軸方向と半径方向では異なるというように各種特性に影響を与える。その他の成形法として特定の型にはめてプレスする方法があり、この方法だと任意の形の成形体が得られるが、押し出し成形同様、プレスによっても異方性が生じる。もうひとつの成形法はCIP成形である。これは原料をゴム製の型に入れて水中で圧力を加える方法です。この場合、静水圧として均一に圧力が加わるため異方性のない(あるいは小さい)等方性の黒鉛が得られる。
3.2.1.2 一次焼成
混ねつ・成形により一定の形状となったものを焼成して形を固定する。焼成温度は約1,000℃処理期間は1ヶ月くらいの長期間処理を行う。
3.2.1.3 ピッチ含浸・二次焼成
一次焼成後の焼成体には隙間があるので一次焼成体をピッチに漬け、圧力を掛けてピッチを浸透させ、さらに二次焼成を行い、ピッチを炭素化する。さらにピッチ含浸と三次焼成を行う場合もある。
3.2.1.4 黒鉛化処理
こうしてできた焼成体を高温で黒鉛化処理を行う。黒鉛化処理の目的はグラファイトの結晶化加を上昇させるためである。
グラファイトはベンゼン環が縮合してできる無限平面が積層してできた層状化合物であり、平面間距離は3.35Åである。リチウムイオン電池は正極と負極の間を電解液を介してリチウムイオン(Li+:イオン半径:0.59Å)が充放電に対応して移動することになる。負極内ではLi+は積層した結晶面の間に移動して層状化合物を形成するが、電流密度など電池の特性を挙げるためには、Li+ができるだけ多く結晶面間に入り込むスペースを確保するために負極全体の結晶化度を上げる必要がある。
3.2.2 黒鉛化処理による結晶度化の評価
炭素材料では、微視構造を表わす物理量として、通常結晶子の層面間隔d0と、そのa軸とc軸方向の大きさLaとLcとの計3個がとりあげられる。LaとLcの値は(110)回折線、(002)回折線などの、低次の回折線の線巾から公式を用いて計算されることが普通であり、その結果、一般的結論として、La、Lcとも、有機物の炭化の初期には20~30Åであるが、炭化と黒鉛化の進行とともに増加し、軟質炭素では3000℃近い温度での黒鉛化により、1000Åあ るいは、それ以上の程度の大きさになるとされている。[水島三知、1968]
図3.2.2に、「トレイプッシャー方式」の連続黒鉛化炉を用い、N2ガス雰囲気中で黒鉛化を行った場合の黒鉛化温度に対するLc(006)および Lc(112)の成長カーブを示した。供試材は二―ドルコークス(サンプルA)、モザイクコークス(サンプルB)および球形化処理ニードルコークス(サンプルC)である。この図より、一般的に言われているように、黒鉛化温度を上昇させることで結晶が成長する様子が確認できた。さらに、原料や粒子形状が異なれば、全く結晶成長性が異なることもわかった。
すなわち、ニードルコークス(サンプルA)は温度の上昇とともに顕著な結晶成長が認められるが、一方、モザイクコークス(サンプルB)の結晶成長はあまり顕著ではない。これはモザイクコークスに含まれる不純物により結晶成長が阻害されたためであり、さらに球形化処理した球形化サンプルCもサンプルBと同様に結晶成長は顕著ではない。この原因 は、球形化処理により結晶に歪みが生じて、結晶成長が阻害されるためと考えられる。[岡崎精二、2016]
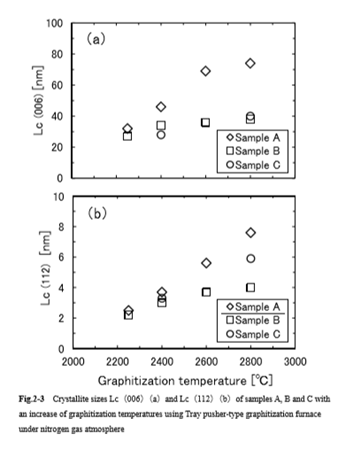
図3.2.2 Lc(006)および Lc(112)の成長カーブに及ぼす黒鉛化温度の影響
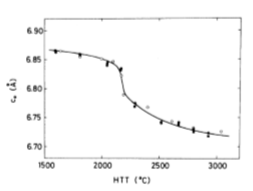
図3.2.3 易黒鉛化性炭素の加熱処理に伴うc0(=2d002)の減少
●:コールタールピッチ、〇:石油系重質油、■:PVC
図3.2.3は、コールタールピッチ、石油系重質油およびPVCの易黒鉛化性炭素について加熱処理温度HTTに対する格子定数C0=2d002の変化を示したものである。[稲垣道夫、1984] 一般的にはHTTが2000℃以上でd002が急激に減少し、黒鉛の3.354Åに近づく。HTTが1500℃付近ではd002の変化は小さく、ほぼ一定の3.45~3.43Åを示した。さらに高温側に昇温すると3000℃付近で、層間間隔が最小値の3.36Åになることがわかった。
これらより以下のことが明らかになった。
①黒鉛化熱処理に伴い、熱処理温度の上昇とともに、六面網面の平面形状は大きくなるが、結晶面の層状間隔は小さくなることが分かった。
②LiBの高電流密度特性等の高性能化を図るためには、できるだけ不純物フリーの高重度化黒鉛をスタート材として黒鉛化熱処理することが重要であることが分かった。
長期間3000℃程度の高温にするのには、加熱設備自体が熱でダメージを受けるなどの問題が発生するため、後述するように、通常は、焼成体に直接通電してジュール熱により加熱するというアチソン炉による熱処理方法が採用されている。
3.2.3 黒鉛化処理を行った場合の炭素材料の形状変化
図3.2.4に、ニードルコークスとモザイクコークスのそれぞれの生コークスおよび カルサインコークスを粉砕、分級した粉末状の炭素材料のそれぞれのSEM像(A- D)を示す。
これらのSEM像より、ニードルコークス(A,B)は、鱗片状粒子になりやすく、モザイ クコークス(C, D)はやや厚みのある米粒状の粒子になりやすいことがわかる。また、生 コークス(A, C)は、粉砕により粒子のエッジ部分に丸みのある粒子になっている様子が 確認できる。 これは、ニードルコークスは針状結晶の結晶面に沿って粉砕が進むが、他方、モザイクコークスは針状結晶性が弱く、モザイク状の結晶構造を持ち、きれいに結晶面で粉砕 されにくいこと、また、カルサインコークス(B, D)は、熱処理により結晶成長し、結晶 粒界での粉砕が進行したためと考えられる。
図3.2.5に、図3.2.4の写真(A)で示したニードル生コークスの粉砕および分級処 理品(以後サンプルAと呼ぶことにする)を黒鉛化処理したときのSEM像を示す。この結果、黒鉛化処理を行うことで粒子形状がさらに鱗片状になっている様子が確認できる。この結果は、上述したような石油系および石炭系のコークス原料は、黒鉛化処理を行うことで、粒子形状が、鱗片状になるという報告と一致する。すなわち、黒鉛化処理を行うことで、六角網平面結晶が成長し、層状の結晶構造となるためと考えられる。
このように粒子形状が鱗片状になる特徴は、強度の点や電気特性などに方向依存性が現れるという問題や、成形体としては、形状を制御し難いという問題につながる。これらの問題を解決するために、炭素材料には、黒鉛化処理を行ったときに等方性の特性を維持するような特徴や、成形体として等方的な性質が得られやすく、流動性の良い球状の粒子形状が求められている。次に炭素材料の球形化を検討した。

図3.2.4 SEM写真 (A)ニードル生コークス、(B) 黒鉛化処理後のニードルコークス、
(C) モザイク生コークス、 (D)黒鉛化処理後のモザイクコークス

図3.2.5 ニードル生コークスの粉砕・分級後のSEM写真
(a)黒鉛化処理前、(b)黒鉛化処理後 (2,800℃)
3.2.4 原料および処理条件が球形化に与える影響
これらの炭素粉末の球形化処理には、粒子に衝撃、せん断、ずり応力、摩擦などの機械的エネルギーを与えることで、固体粒子の活性・反応性を高め、周囲の物質と化学反応を起こすというメカノケミカル法(MC法)を利用した。図3.2.5に、サンプルAおよびサンプルB (図3.2.4の写真(B)で示したニードルカルサインコークスの粉砕および分級処理品)を原料とし、粉体処理装置を用い、回転羽 根の周速を30m/sで60 minおよび周速80m/sで60 minの処理を行った場合のSEM像を示す。
図3.2.5より、周速が30m/sの場合、生コークスおよびカルサインコークスいずれの 場合も粒子のエッジが削れて、丸みを帯びているが、粒子形状は大きく変わっていないことがわかる。
<参考文献>
○稲垣道夫、1984、炭素、1984巻、118号、pp.165-175.
○大谷朝男、1988、TANSO, Vol.1988, No.132, pp.32-43.
○岡崎精二、2016、広島大学博士論文.
https://ir.lib.hiroshima-u.ac.jp/files/public/4/40319/20160609133707455009/k7018_3.pdf
○小野富三、1964、北海道立工業試験場報告
○小野富三、1967、北海道立工業試験場報告
○真田雄三、1969, TANSO, Vol.1969, No.59, pp.291-297.
○杉本久典、2007、炭素、連載講座、No.228、pp.215-219.
○東日本株式会社、2020、ホームページ、
http://eastjp-carbon.co.jp/graphitepowder.html
○水島三知、1968、炭素、1968巻、52号、pp.9-12.
○Mochida, I., 1980, Yuki Gosei Kagaku, 38-6,pp.433-446.
○Tano, T., et.al, 2009, TANSO, No.239, pp.180-183.
○Tojo, J., TANSO, No.234, pp.234-243.
第4章 セパレータ
4.1 リチウムイオン電池(液系LIB)とそのセパレータ [藤原勝壽、2019]
非水系有機電解液を用いるリチウムイオン電池のセパレータは、電解液の有機溶媒に対して耐性を有していなければならない。したがって、リチウムイオン電池の場合はポリオレフィン系微孔膜のセパレータが用いられている。非水系有機電解液の場合に注意を要するのは、単に有機溶媒に対する耐溶剤性だけではなく、溶解解離しているLiイオンとの相互作用を充分に考慮しなければならないという点である。解離したLiイオンは、意外にも材料に対する腐食性が大きく、特に高温での耐性を充分に評価の上、材料の設計と選定を行うことが重要である。
電池の起電力は、正極と負極の酸化還元電位の差により発生する。したがって、正極は貴な電位状態となり、セパレータの正極に接する面には耐酸化性が要求される。各蓄電デバイスの正極電位はほぼ類似の電位にあり、耐酸化性という点では共通的な要求特性になっている。しかしながら、水系蓄電デバイスの場合は、単に電位の問題だけでなく、充電時に発生する活性酸素に対する耐性も必要である。
一方、負極は逆に卑な電位となるので、セパレータの負極に接する面には耐還元性が要求される。各蓄電デバイスの負極電位は大きく異なり、4V以上の起電力を有するリチウムイオン電池の負極はアルカリ金属と同等の卑な電位となる。したがって、ナトリウム金属、リチウム金属と直接接触しても耐えるくらいの耐還元性が要求される。
セパレータの厚みは、体積効率を考えれば薄いのが好ましい。リチウムイオン電池の場合は、電気絶縁性を損なわない範囲で薄く設計され、現在では15 μm前後の極薄セパレータが標準となっている。セパレータの孔径は、イオン透過性を損なわない範囲で小さいことが望ましい。シャットダウン効果については、安全性を保つという重要な機能を呆たしており、特にリチウムイオン電池の場合に重要な要求特性である[吉野彰、2015]。
4.2 車載用・現行及び先進LIB(液系)セパレータの特徴と市場規模
自動車業界のEVシフトの動向が世界レベルで著しくなっており、二次電池用セパレータの年産能力増強のニュースリリースが相次いでいる。主要セパレータメーカー各社の特徴を表4.2.1に示す[旭化成、2018],[宇部興産、2018],[住友化学、2016],[帝人、2018]。車載用LIBセパレータメーカーの製造技術の特徴を集約すると次のとおりである。
・環境に優しいポリオレフィン製平膜をベースとするものが多く、用途に応じて多様な膜厚から選択可能であり、膜厚の均一性が高く長尺化ができる。
・細孔径には多様なバリエーションがあり、目的に応じた正負極物質問の絶縁性やイオン透過性を有する。また、気孔率が高く、優れた保液性を有する。
・強度が高く、安全性、信頼性が向Lしている。
・安全性確保のため、セパレータ平膜に無機粉体を塗布する技術のほか、ポリオレフィン基材にアラミド樹脂で耐熱層を形成して耐熱性を向上している。
・ポリエチレン基材に、電極との接着性や耐酸化性に優れるフッ素系化合物をコーティングした耐熱性と接着性を高めた新しいセパレータも開発されている。
表4.2.1 主要各社のLIB(液系)セパレータの特徴

4.3 車載用LIB(液系)セパレータの世界市場規模
リチウムイオンニ次電池材料の世界市場規模は、株式会社富士経済が調査した結果によると、図4.3.1に示すとおりである。従来のスマートフォン・ノートパソコン等の民生用に加えて、自動車向けを中心としたリチウムイオンニ次電池の需要増加によって材料市場も拡大が予想され、2021年には2016年比2.1倍の2兆9,024億円が予測されている。自動車向けリチウムイオンニ次電池では、航続可能距離の向上を目的とした電池の高容量化と安全性の確保が継続した課題である[富士経済、2017]。
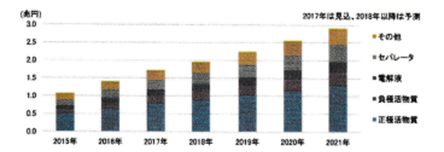
図4.3.1 リチウムイオン二次電池材料世界市場規模 [富士経済、2017]
セパレータは正極と負極を電気的に絶縁し電解液(有機グル)を担持する役割を担う。また、耐熱材料をコーティングして安全性・強度を高めたコーティングセパレータの需要が増加しており、特に自動車向けではスタンダードになっている。2016年のシェアトップ3は日系メーカーが占め、それらを含めトップ10にランクインした日系メーカーは6社とまだ優位性を保っている。主要4材料の中では中国メーカーの台頭が緩やかであり、全体における割合は41%と低い。セパレータの市場規模は、2016年が約2,100億円で、2021年には約4,800億円程度と予想されている。これに伴い、セパレータメーカー各社の2020年頃の年産能力は、車載用セル需要が牽引役となり、2017年比約2倍の規模になる見込みと予想されている。
4.4 LIBの構成とセパレータの機能 [石原毅、2017]
セパレータはLIBの中で、負極と正極の間に挿入され使われている。図4.4.1に代表例として、円筒の電池を示す。通常の電池においては、電気絶縁性を担保するという最も基本的な能力を発揮する必要がある。同時に、リチウムイォンがこのセパレータを通して移動することで電池が機能することから、短期的な出力特性のみならず、長期的な寿命で透過性を担保することが当然ながら必要となる。
通常時の電池機能に加えて、異常時の安全性確保という点から、電池が異常になった場合に、セパレータとして果たすべき機能が二つある。一つ目が、電池に機械的変形が加わった場合にも電極間の絶縁性を保つという「機械的強度J、二つ目が、何らかの異常反応が起こって電池内に高温な条件が発生した場合、セパレータの穴が塞がり、電極間のリチウムイオンの流れを停止して安全に電池の機能を止める「シャットダウン(SD)機能J、三つ目が、リチウムイオンの流れを遮断した後、さらに電池内の温度が上がった場合においても電極間の短絡を防ぐという機能、溶融形状保持性、「メルトダウン(MD)特性」である。
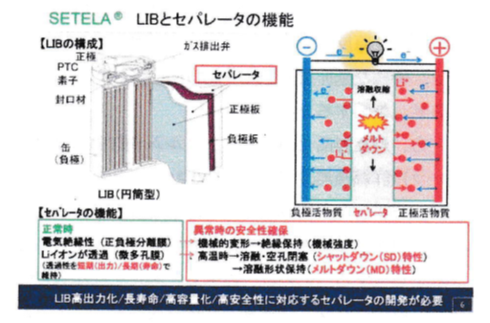
図4.4.1 LIB構造とセパレータの機能
4.4.1 微多孔膜セパレータの開発状況 [藤原勝壽、2019]
微多孔膜の製造方法としては、乾式の延仲開孔法と湿式の相分離法がある(図4.4.2)。乾式の延伸開孔法では、ポリエチレン(PE)やポリプロピレン(PP)の溶融ポリマーをシート化して、さらに熱処理によって積層ラメラ構造を形成させ、一軸延伸によって結晶界面の剥離を行うことで、長円形の微多孔を形成するものであり、開孔径が小さく、異方性が大きいなどの特長がある。PEとPPの多層貼り合わせ膜として利用されることも多い。
一方、湿式の相分離法では、ポリマーと溶剤を力熱溶融してシート化することでミクロ相分離させ、その溶剤を抽出除去しながら一軸あるいは二軸延伸して孔径と形状の制御を行うものであり、複雑な形状の微多孔を形成して、異方性が小さく、開孔径が大きく、引張強度が高いなどの特長がある(図4.4.3)。
微多孔膜系セパレータは、空隙率が用途に応じて30~60%、民生用途では厚みが5~ 25μm、車載や産業用では15~40μmの範囲で制御される。ただ、PEやPPをベースにした微多孔膜では、120℃ 付近から膜の熱収縮が始まるため、表面に耐熱性樹脂やセラミックなどを塗布して、耐熱温度を180℃ 付近まで向上させることが行われている。この表面コートによって、電解液保持性の向上や、正極や負極表面の安定性が向上して、耐久性や安全性が飛躍的向上する例も報告されている。
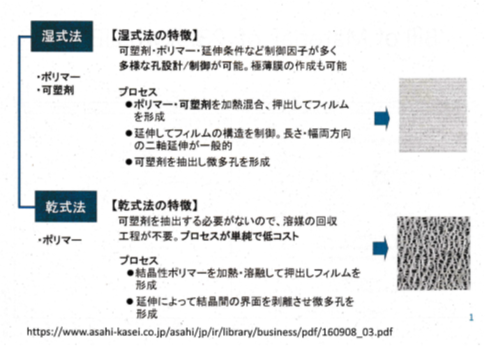
図4.4.2 LIB用セパレータの製法

図4.4.3 LIB用セパレータの種類
図4.4.4に表面コートセパレータの断面例を示す。表面コートの種類は、「耐熱性コート」と「接合性コート」に分類できる。例えば、セパレータの耐熱性や安全性、耐久性を大幅に改善するために、ポリオレフィン系微多孔膜の膜表面にアラミド繊維層およびアルミナ層を形成して、電気自動車やノートPC向け等に提供している。また、セパレータ表面に正負極に用いられるバインダーと同じPVdF(ポリフッ化ビニリデン:PolyVinylidene diFluoride)や、電解液でグル化しやすいフッ素系樹脂をコートすることで、電極積層体の接合性を向上させ、ラミネート電池の性能向上を図っている。接合性コートは、正極と負極の接合性を向上させるために両面にコーティングがなされる[堺哲男、2017]。
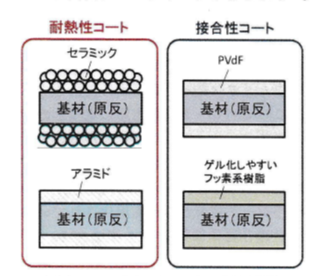
図4.4.4 コートセパレータの断面例 [堺哲男、2017]
4.4.2 セパレータ表面の無機物層塗布
近年、特に出願件数の多いのがセパレータ表面の無機物層塗布という技術である。ポリオレフィン系セパレータの課題の1つは、シャットダウン後に、さらに温度が上昇した時にセパレータの破膜が起こり、電流遮断効果が損なわれるという点である。この課題を解決する手段の1つとしてセパレータの表面に多孔性の無機物層を塗布する技術の開発が盛んに行われている。基体となるシャットダウン効果を有するポリオレフィン系セパレータの表面に無機物を含有した多孔性耐熱層を形成させることにより、高温時の破膜を防止するものである。
無機物としてはガラス質材料、耐酸化性セラミック粒子、粘土鉱物、金属塩化合物、板状フィラーなどが提案されている。最も一般的な無機物は、アルミナ、シリカ、チタニア、マグネシアなどである。この無機物層を形成するに必要なバインダー樹脂としては、やはり耐熱性の芳香族ポリアミド樹脂、ポリイミド樹脂等が用いられている。共通する作用効果は無機物層の形成により、高温時の破膜が起こらないことから高温安全性の向上、過充電時の安全性の向上、さらには耐酸化性の無機物層が表面に形成されるのでセパレータの正極に接する面の安定性の向上などが知られている[吉野彰、2017]。
4.4.3 積層セパレータ
既存のポリオレフィン系セパレータでもポリエチレン層とポリプロピレン層との積層化という技術は採用されている。ここではポリオレフィン系セパレータ同士以外の積層セパレータ技術を次世代セパレータとして分類した。この技術の目的は低温シャットダウン機能と高温破膜防止の両立である。従って、積層の組み合わせの対象としてポリオレフィン系樹脂と耐熱性樹脂の例が多い。耐熱性樹脂の具体例としては液晶ポリエステル樹脂、ポリフェニレンエーテル樹脂、芳香族ポリアミド樹脂、ポリイミド樹脂、 ポリアミドイミド樹脂、耐熱性アクリル樹脂、架橋性ポリマーなどが提案されている[吉野彰、2017]。
4.5 セパレータ製造フロー
リチウムイオン電池においてセパレータは、正極・負極が直接接触し短絡することを防ぎつつ、電解液やLiイオン等を通過させる役割を持っている。実用化されているセパレータの材質はPPやPEといったポリオレフィン系が主流であり、厚みが15~30μm程度の多孔体である。また、電池が内部短絡等の異常状態になり、電池の温度が作動範囲を超えて大きく上昇した場合は、セパレータのシャットダウン機能というものが働くよう、一般的には設計されている。シャットダウン機能とは、セパレータが少し融け多孔部が閉じられることで内部抵抗が急激に上昇し、短絡電流を抑制する機能のことである。ただし、あまりにも急激な発熱が起きた場合など、多孔部が閉じられ内部抵抗が上がる前にそのセパレータの融点を超え穴が開くほど融けた場合は、正極と負極が接し熱暴走に発展するケースも少なくない。
セパレータ材の合成方法は乾式と湿式という2種類の方法に大きく分けられる。
4.5.1 乾式
まず、元となるポリマーに熱をかけ溶融状態になっているものを薄く押し出す。次に
冷却を行うと同時に引き延ばしていくことで、孔ができやすい部分(球晶)から孔が成長する。単純に引き延ばしてあるため、一般的に孔は直線的になる。乾式製造の長所は製造工程がシンプルであるため低コストであることや、孔が直線的になるためLiイオンの移動経路が短く、移動抵抗を抑えられることが挙げられる。一方、乾式の短所としては、製造工程がシンプルであるため、孔径などの制御は難しく、径が狙いより細すぎた場合などは移動抵抗が大きくなってしまう場合がある。逆に径が大きすぎた場合は異常時に熱暴走に繋がりやすいことや微小短絡を起こしやすいことが考えられる。
図4.5.1にBOPP(Biaxially Oriented Polypropylene Film)フィルムの製造工程を示す。ポリプロピレン(PP)を主原料とし縦方向と横方向に二軸延伸したフィルムであり、二軸延伸によってフィルムの機械的強度と光学的特性に優れ、食品包装から工業用まで幅広く利用されている。
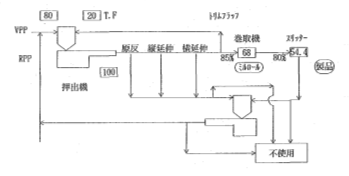
図4.5.1 BOPPフィルムの製造工程 [JICA report, 1991]
図4.5.1の場合は、一度縦に延伸してその後横に延伸するという二段延伸を取っているが、これを一括して行う二軸延伸もある。図4.5.2に、プラスチックフィルムの製造に使われている同時二軸延伸装置の概略図を示す。なお、押し出された三次元のプラスチックフローを平面上に転換するのがTダイである。
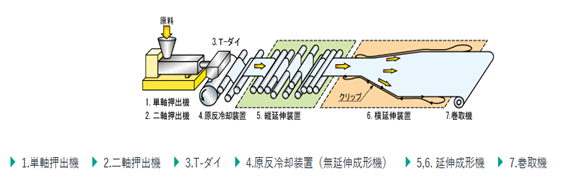
図4.5.2 同時二軸延伸装置 [西華産業株式会社、2020]
4.5.2 湿式
まず、元となるポリマーに熱をかけ溶融状態になっているものを薄く押し出す。ここで元となるポリマーには可塑剤と呼ばれるものも混ぜ込んでおり、冷却工程に移る際にこの可塑剤をうまく取り出すことで孔を作っている。
湿式の長所は可塑剤を入れているため、可塑剤や元のポリマーの物性を制御することで孔径や3次元的な構造制御が可能である。短所は孔が直線でなく3次元的構造であるため、Liイオンの移動経路が長く、抵抗が大きくなる場合がある。さらに、可塑剤を加え、混練、除去工程があるため、工程が若干複雑になり、コストが乾式と比べて高くなる傾向にある。
このように乾式、湿式ともにメリット、デメリットがあるが、最後は求められる電池により最適化が必要で、かつセパレータ単体でなく、電池としての各種評価を行うことが大切である。下記にセパレータに求められる特性別に解説する。
① 内部抵抗(電荷液中のLiイオンの移動抵抗)
電池の出力密度を上げるためには内部抵抗の低減が必要である。セパレータではLiイオンの移動抵抗を低減することが可能です。まず、上述したように乾式、湿式の選択、また条件の最適化により孔の長さを短く、安全性を損なわない範囲で孔径を大きくすることで、Liイオンの移動抵抗を小さくできる。また、セパレータの厚み自体を薄くすることで、移動抵抗は小さくできるが、こちらも安全性とトレードオフな関係である。
② 電位窓が広いこと、耐電解液性を有していること
電解液等の他の部材と同様に、セパレータも電位窓が広いことや他の部材との相性(たとえば耐電解液性を有していること)が良いことが求められる。
③ 機械的強度が高いこと
製造段階で正極、負極とセパレータを合わせてエレメントを形成している。この段階で、巻き取りもしくはスタックしていくのですが、どちらの方式でも正極や負極の位置がずれないように、張力をかけます。そのため、この張力に耐えられるレベル以上の機械的強度が求められる。
④ 安全性、耐熱性が高いこと。
⑤ ①でも解説したように、セパレータを薄くすると内部抵抗の低減につながるが、薄くし
過ぎると異常時の発熱でセパレータに穴が開くことで安全性の低下につながる。厚いほど安全性が高いと言える。また、70℃~100℃を超える範囲での使用を想定している場合は通常のポリオレフィン系でなく、耐熱性セパレータが必要となる。
⑥ 低コスト
どの部材でもいえるが、コストが安いことが求められる。
4.6 二次電池製造における塗布・塗工・接着[KEYENCE, 2020]
リチウムイオン二次電池のセルの外装は最終用途によって、円筒型、角型、ラミネート(パウチ)型などがあり、製造工程もさまざまである。金属缶タイプに比べて薄型・軽量で、成形の自由度が高く、廃棄が容易で低環境負荷であることから、アルミ箔と樹脂を接着剤の塗工(塗布)で貼り合わせたラミネートフィルムで、積層電極(積層エレメント)を封止する「ラミネート型セル」へのニーズが高まっている。
4.6.1 ラミネート型セル製造における接着
リチウムイオン二次電池セルは、正極と負極の間にセパレータを挟んで交互に重ねた「積層電極(積層式エレメント)」などを封止して製造する。ラミネート型セルは、薄型・軽量でありながら大容量を実現できると同時に、表面積が広く放熱性が高いため、充放電時の温度上昇を抑えることができる。また、塗工装置を用いて大量生産できるため製造コストの面でもメリットがある。図4.6.1にラミナート型セルの構造(積層電極の例)を示す。
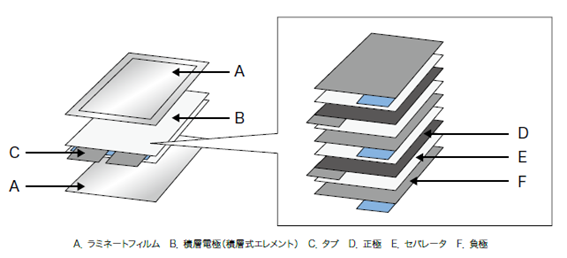
図4.6.1 ラミナート型セルの構造(積層電極の例)
ラミネート型セルの封止・外装に使用するラミネートフィルム(図中A)には、一般的にアルミ箔と樹脂フィルムが用いられる。これらに特殊な接着剤を塗工(塗布)し、ラミネートで貼り合わすことで積層電極と電解液を封止する。ラミネートフィルムに使用する接着剤にはアルミ箔と樹脂フィルムの異種基材に対する強い接着力と、内包する強酸性の電解液への耐性が求められる。
4.6.2 二次電池製造における「機能付与・表面処理」
リチウムイオン二次電池(LiB)の製造工程において、塗工(塗布)は核となる技術である。基材に材料を塗布(塗工)することで、正極(アノード)・負極(カソード)、それらを隔てるセパレータとしての機能を付与し、積層電極(積層式エレメント)の部材を製造する。
図4.6.2にリチウムイオン二次電池(LiB)製造における塗工(塗布)の模式図を示す。
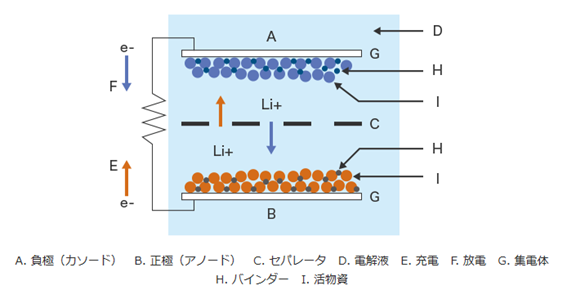
図4.6.2 リチウムイオン二次電池(LiB)製造における塗工(塗布)の模式図
4.6.3 正極(アノード)の塗工(塗布)
4.6.3.1 正極スラリー(溶剤系)の例
活物質、導電助剤、バインダー、有機溶剤を混合させたものである。なお、水系の場合は、有機溶剤でなく増粘剤であるCMCと水を加える。
• 活物質:容量や電圧、特性に大きく関わる。材料(例:コバルト酸リチウム、マンガン酸リチウム、リン酸鉄リチウムなど)の選定や混合、攪拌方法は、企業によって多種多様である。
• 導電助剤:内部抵抗を小さくして導電性を向上させる。
• バインダー:集電箔に混合した材料を結着させる。
• 有機溶剤:材料の混合・撹拌を促し、スラリーを塗工に適正な粘度にする。
4.6.3.2 正極スラリーの塗工(塗布)の例
集電箔であるアルミ箔に対し、正極スラリーをダイコータを使って、一定の厚みで塗工(塗布)する。電極の厚みや質量は、電池のエネルギー密度に大きく影響する。塗膜が厚いほど容量が大きくレート特性が低下し、薄いほどレート特性が向上する一方、容量が小さくなるといわれている。
4.6.4 負極(カソード)の塗工(塗布)
4.6.4.1 負極スラリー(溶剤系)の例
活物質、バインダー、有機溶剤を混合させ、負極用のスラリーをつくる。なお、水系の場合は、有機溶剤でなく増粘剤であるCMCと水を加える。
• 活物質: 導電性が高い炭素系材料(黒鉛、チタン酸リチウムなど)を使用する。負極にも導電助剤を入れて、内部抵抗を低下させる場合もある。正極と同様に、活性剤の容量や電圧、特性に大きく関わる。材料の選定や混合、攪拌方法も企業によって多種多様である。
• バインダー:集電箔に混合した材料を結着させる。
• 有機溶剤:材料の混合・撹拌を促し、スラリーを塗工に適正な粘度にする。
4.6.4.2 負極スラリーの塗工(塗布)の例
銅箔に対し、ダイコータを用いて負極スラリーを一定の厚みで塗工(塗布)する。一般的に、負極の方が正極に比べて薄い塗膜を形成する。塗膜の厚みによる容量やレート特性の変化は、正極の塗布と同様で、正極・負極の容量バランスも重要で、一方の電極の膜厚が厚くなるともう一方の電極も厚くするケースが多い。
4.6.5 セパレータの組立工程
正極と負極を隔てる重要な部材であるセパレータの製造工程を下記に示す。ベース膜への耐熱性能付与のコーティングに塗工(塗布)が用いられている。
1.ベース膜製膜工程:ポリオレフィン原料から「ベース膜(微多孔膜)」を製膜する。
2.塗工工程:アラミド塗工液(アラミドポリマーを合成した塗工液)をベース膜上に均一に塗工(塗布)し、耐熱層を形成する。
3.スリット工程:必要なサイズに裁断する。
EV(電気自動車用)や家庭用蓄電池などへの活用がみられる「ラミネート型LiB電池」には、積層電極(積層式エレメント)が使用されている。
積層電極の製造工程では、積層式用にシートカットされた正極・負極を用い、最外層に負極を配置し、次にセパレータ・正極・セパレータ・負極といった順番に積層し、それを電解液とともにセルとしてパッケージする。
4.7 電池製造における塗工品質の管理
電極材の膜厚は、容量や電圧、レート特性と大きく関係し、設計通りの性能や仕様で量産するには、目的の膜厚を連続して均一に塗工(塗布)する必要がある。万一、塗工面に「厚みムラ」や端面の「耳立ち」といった発生した場合、電池製品の品質・性能に大きく関与するため、インラインでの塗工面の高速・高精度な測定・管理が重要となる。
インラインで高速・高精度な測定が可能な「マルチカラーレーザ同軸変位計」を導入することで、塗工表面の粗さやレーザが反射しにくい材料に影響されず、安定した厚み測定・管理が可能となる。塗工端面の厚みが過剰となる「耳立ち」などの塗工欠陥は、スリット状のレーザで形状測定できる「超高速インラインプロファイル測定器」を用いることで、塗工不良をインラインで検出することができる。
塗布(塗工)による、高機能・高効率なものづくりが脚光を浴びる昨今、各種コータやディスペンサによる自動塗布が目覚ましく発展している。こうした塗布装置の複雑化、塗布の薄膜化・精密化を背景に、量産の現場における高速かつ高精度な塗布検査、装置の監視・制御への要求が増加している。
<参考文献>
○旭化成、2018、http://www.asahi-kasei.co.jp/hipore/[saved,2018/09/27]
○石原毅、2017、The TRC News, 201705-01,
https://www.toray-research.co.jp/technical-info/trcnews/pdf/201705-01.pdf
○上原宏樹、2014、国際特許、WO2014/034448 A1.
○宇部興産、2018、ニュースリリース2018.9.5、リチウムイオン電池用セパレータ設備増強について
○境哲男、2017、加工技術研究会、「機能紙最前線J、p l10-116.
○住友化学、2016、ニュースリリース2016.09.07、リチウムイオンニ次電池用セパレータの生産能力を増強
○西華産業株式会社、2020、ホームページ。
http://www.seika.com/product/fiber/filem/firm_produce
○帝人、2018、ニュースリリース2018.2.6、革新的セパレータの第3系列稼働について
○富士経済、2017、電池関連市場実態総調査 下巻
○藤原勝壽、2019、セパレータから見たリチウムイオン電池(LIB)の課題と展望(Part1)、繊維学会誌、75-1, pp.42-48.
○吉野彰、2017、加工技術研究会、「機能紙最前線J、p104-109.
○吉野 彰、2015、リチウムイオン電池用セパレータの技術動向、機能紙研究会誌、54,913.
○JICA report, 1991, 中国工場近代化計画調査報告書.
https://openjicareport.jica.go.jp/pdf/10879088_03.pdf
○KYENCE、2020、KEYENCEホームページ<工業製品の製造における塗布<二次電池製造における塗布・塗工
https://www.keyence.co.jp/ss/products/measure/sealing/production/battery.jsp
○NEDO、2015、技術戦略研究センターレポート、車載用蓄電池分野の技術戦略策定に向けて、TSC Foresight, Vol. 5(2015年10月).